La clonidine est un alpha-2 agoniste adrénergique. Le récepteur α2 a pour ligand naturel la noradrénaline, neurotransmetteur essentiel du système sympathique. La clonidine a une affinité 200 fois plus grande pour le récepteur α2 que pour le récepteur α1. Sa biodisponibilité per os est proche de 100%. Sa demi-vie est longue : 12 à 24 heures. La moitié de la dose absorbée est excrétée inchangée dans les urines. L’insuffisance rénale ralentit l’élimination de la clonidine.
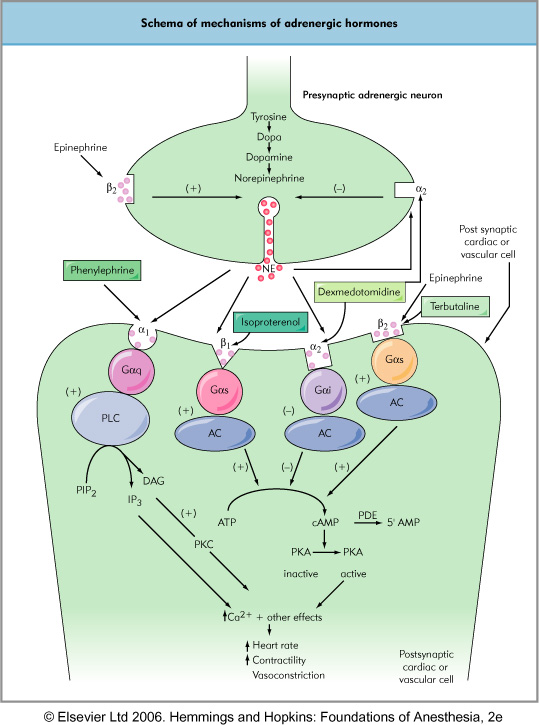
Le récepteur α2 est majoritairement présynaptique. Son rôle physiologique est de participer au rétrocontrôle négatif de la sécrétion de noradrénaline. En se liant au récepteur α2 présynaptique, la clonidine diminue la sécrétion de noradrénaline dans la fente synaptique.
Une des actions les plus visibles de la clonidine est de déprimer les noyaux vasomoteurs dans le tronc cérébral, gommant ainsi à la fois le tonus de base et la réactivité sympathique. La clonidine induit donc une tendance à la bradycardie et à l’hypotension.
Par ailleurs, la noradrénaline a des vertus analgésiques par le biais des récepteurs α2 notamment dans la corne dorsale de la moelle. Cet effet est cohérent avec la logique « Fight or Fly » du système sympathique. Par son affinité au récepteur α2 la clonidine active les mêmes voies intracellulaires que la noradrénaline endogène. Il s’agit d’ouvrir un canal potassique facilitant « l’hyperpolarisation » de neurones WDR (wide dynamic range), déprimant ainsi leur activité. Ces neurones sont habituellement stimulés par des fibres Aδ ou C provenant de la périphérie. La clonidine peut donc émousser un afflux nerveux nociceptif.
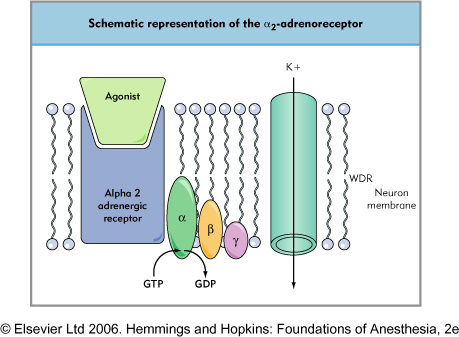
Ensuite, la clonidine va également agir au niveau du loecus coeruleus lié à la régulation de l’état de veille. La stimulation α2 va provoquer une sédation avec un certain de gré d’indifférence à l’environnement propice à une utilisation en réanimation.
Ainsi, le tableau général qui résulte de l’action de la clonidine est un blocage des effets hémodynamiques de la noradrénaline endogène (diminution activité α1+++) tout en conservant l’activation de systèmes analgo-sédatifs.
La clonidine peut être utile au patient en pré- per- et post-opératoire. Elle est ainsi utilisée en prémédication, en pédiatrie et chez les adultes . A titre personnel, je l’utilise souvent dans mes prémédications, surtout lorsque j’arrête des IEC des ARA2 ou l’aliskiren avant une intervention. Je propose de la clonidine (1 à 2 µg/kg) per os si le patient a une pression artérielle élevée à son arrivée à l’hôpital (stress et diminution de l’imprégnation par les bloqueurs du système rénine angiotensine) voire même le matin de l’intervention.
En périopératoire, on observe que la clonidine potentialise les effets des hypnotiques et des morphiniques. Ainsi lorsque l’on emploie de la clonidine, on peut très sensiblement diminuer les posologies de propofol, de gaz halogénés et des morphiniques en per et en post-opératoire . Lorsque l’on est peu habitué à manier la clonidine, la peur de la douleur ou d’une profondeur d’anesthésie insuffisante fait que l’on poursuit les hypnotiques et les morphiniques à des posologies usuelles. Dans cette situation on bascule clairement rapidement dans une situation de surdosage anesthésique avec des conséquences hémodynamiques marquées. Cela sera d’autant plus visible que la clonidine a été administré en bolus à un patient en hypovolémie (relative ou patente.)
Ces manifestations font craindre une mauvaise perfusion tissulaire. Pour moi, il faut d’abord nourrir la réflexion autour de deux axes avant d’accuser les α2 agonistes de compromettre la perfusion tissulaire :
- D’abord, je pense qu’il existe des situations où il y a un décalage entre ce qui se passe au niveau macrocirculatoire (que l’on voit et mesure) et au niveau microcirculatoire. La clonidine abaisse vraisemblablement les résistances vasculaires systémiques mais avec un patient stable, de chirurgie programmée ayant une volémie adéquate, je pense que le débit cardiaque reste adapté (la VO2 baisse sensiblement pendant une anesthésie générale.) Pour prolonger cette réflexion il y a des études en chirurgie cardiaque qui montre que l’utilisation de la clonidine permettrait d’éviter des accidents ischémiques myocardiques . Il y a fort à penser que les variations hémodynamiques brutales et les décharges de catécholamines sont ce qu’il y a de plus délétères pour les « patients vasculaires ». Ainsi la clonidine trouve une raison d’être dans le contrôle du stress sympathique qui dépasse parfois les capacités adaptatives du patient.
- Dans la littérature scientifique le blocage des voies noradrénergiques n’a pas d’effet hémodynamique dramatique (surtout en terme de pronostic) lorsque la clonidine est testée seule, notamment avec une administration lente et continue pour une sédation en réanimation. Comme je l’écrivais plus haut, je pense qu’il faut que nous apprenions à manier correctement la clonidine. Malheureusement les recommandations sur l’analgésie ne nous encouragent pas à ça puisque la SFAR ne recommande purement et simplement pas son utilisation comme adjuvant d’une anesthésie générale et comme antalgique en post-opératoire. Il me parait vraisemblable que ce désamour vienne d’un manque de culture dans le maniement de ce médicament. Les anesthésistes qui utilisent de fortes doses d’α2 agonistes comme certaines équipes belges ou les réanimateurs anglo-saxons qui l’utilise comme sédatif nous prouvent dans leurs travaux qu’il y a une place pour une utilisation bénéfique pour le patient, à nous d’apprendre auprès d’eux !
La clonidine peut s’utiliser selon différentes voies d’administrations, en intraveineux ou en périmédullaire notamment. Les conséquences hémodynamiques sont comparables. Lors d’une utilisation en épidural, les agents anticholinestérasiques comme la neostigmine peuvent aider à maintenir une hémodynamique rassurante. L’équipe bruxelloise de Marc De Kock qui cherche à limiter les morphiniques au maximum utilise parfois exclusivement la clonidine en péridural pour l’analgésie . Frappant non ?
Les α2 agonistes ont d’autres vertus intéressantes. La clonidine a des effets sur la thermorégulation. Ainsi, elle est utile pour prévenir le frisson post-anesthésique à la physiopathologie complexe . La clonidine joue également un rôle préventif des nausées et vomissements post-opératoires (NVPO) . Il est fort probable que la diminution des besoins en morphiniques soit l’explication principale. En anesthésie loco-régionale, la clonidine prolonge les effets des anesthésiques locaux . Il existe aussi des propriétés méconnues avec des pistes de recherche à défricher : effet diurétique (effet sur l’ADH et l’ANP ?) et effet d’épargne azoté .
La plus grande difficulté est de se construire une expérience solide pour trouver les bonnes indications où la clonidine apporte un plus aux patients. Pour moi les jeunes avec un terrain très neurotonique, les addictifs sévères (énervés ou qui peuvent le devenir rapidement…), les douloureux chroniques (ou un terrain à risque), les coronariens qui s’accélèrent et qui montent leur pression artérielle sont de bonnes indications. Lorsque j’en ai la possibilité j’utilise préférentiellement la clonidine en périmédullaire avec une administration continue plutôt qu’en bolus IV.
En réanimation, la clonidine, et sa cousine la dexmetomidine constitue des sédatifs intéressants dont l’utilisation reste à définir. Une revue récente de l’utilisation des α2 agonistes en réanimation a été publiée dans les AFAR , c’est un must-read.
Enfin la clonidine et la recherche fondamentale autour des α2 agonistes précisent notre compréhension des mécanismes de l’anesthésie générale. Nos collègues de la médecine vétérinaire ont notamment bien creusé la piste de l’utilisation des α2 agonistes pour induire une hypnose mais ils ont aussi testé avec succès la réversion de l’anesthésie avec l’utilisation d’α2 antagoniste comme l’atipamezole .
Notez aussi pour l’anecdote que sur la piste de la stimulation des voies noradrénergiques pour moduler l’état de veille, des médicaments construits et vendus comme « psychostimulants » (le modiodal et son ancienne prodrogue l’adrafinil) ont été détournés de leur usage médical comme dopant.
En conclusion, je pense que la modulation du système sympathique est une voie de recherche passionnante pour les anesthésistes-réanimateurs, ne mettons pas trop vite les α2 agonistes de côté, cherchons plutôt à mieux les apprivoiser et puis qui sait peut être qu’un jour on facilitera le réveil d’une anesthésie générale en utilisant des alpha2-antagonistes …
POST-SCRIPTUM : j’utilise la clonidine comme ça : 4 amp de 150 µg (=600 µg) dans 20 ml sur une seringue trois pièces. En seringue auto-pulsée, je titre pour que le patient soit calme aux soins intensifs et/ou sur l’hémodynamique au bloc. Je commence souvent à 1 µg/kg/heure (environ 2 ml/h), moins chez la personne âgée et je titre. J’ai remarqué que l’efficacité pointait tranquillement le bout de son nez lorsqu’on avait atteint 1 µg/kg. La lecture de l’article de l’AFAR est vraiment intéressant, lisez le ! n’oubliez pas que ça n’est pas une panacée, qu’il existe des situations où ça n’est pas le médicament adéquat…
« Ce texte est publié sous licence Creative Commons Paternité-Partage des Conditions Initiales à l’Identique 3.0 Unported » Auteur = nfkb, médecin anesthésiste-réanimateur, auteur de ce blog
{858234:3NW5NTIM};{858234:JF3K3EMN},{858234:WU3ZTKHM};{858234:TUNDDG8V},{858234:6T73TWAZ};{858234:DA99X2KI};{858234:CSHN6E84};{858234:4Q2HSF4R},{858234:TGW4DVDV};{858234:ZGZKIVZE},{858234:4FUT74CA};{858234:KKEAWGPT};{858234:NEATSN2D};{858234:TFK8B56Q};{858234:J5RJTKBE};{858234:U5IHCDIC}
apa
default
asc
no
3799
%7B%22status%22%3A%22success%22%2C%22updateneeded%22%3Afalse%2C%22instance%22%3A%22zotpress-a69ce049e77622f4b525fb8432580ec9%22%2C%22meta%22%3A%7B%22request_last%22%3A0%2C%22request_next%22%3A0%2C%22used_cache%22%3Atrue%7D%2C%22data%22%3A%5B%7B%22key%22%3A%22WU3ZTKHM%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Chan%20et%20al.%22%2C%22parsedDate%22%3A%222010-12%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%3EChan%2C%20A.%20K.%20M.%2C%20Cheung%2C%20C.%20W.%2C%20%26amp%3B%20Chong%2C%20Y.%20K.%20%282010%29.%20Alpha-2%20agonists%20in%20acute%20pain%20management.%20%3Ci%3EExpert%20Opinion%20on%20Pharmacotherapy%3C%5C%2Fi%3E%2C%20%3Ci%3E11%3C%5C%2Fi%3E%2817%29%2C%202849%26%23x2013%3B2868.%20%3Ca%20href%3D%27https%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1517%5C%2F14656566.2010.511613%27%3Ehttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1517%5C%2F14656566.2010.511613%3C%5C%2Fa%3E%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Alpha-2%20agonists%20in%20acute%20pain%20management%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Albert%20Kam%20Ming%22%2C%22lastName%22%3A%22Chan%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Chi%20Wai%22%2C%22lastName%22%3A%22Cheung%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Yeow%20Kuan%22%2C%22lastName%22%3A%22Chong%22%7D%5D%2C%22abstractNote%22%3A%22IMPORTANCE%20OF%20THE%20FIELD%5Cn%5CnThis%20review%20explores%20the%20significance%20of%20alpha-2%20agonists%20used%20clinically%20in%20acute%20pain%20management.%5Cn%5Cn%5CnAREAS%20COVERED%20IN%20THIS%20REVIEW%5Cn%5CnAlthough%20alpha-2%20agonists%20have%20been%20reported%20to%20have%20an%20analgesic%20effect%2C%20they%20are%20not%20commonly%20used%20clinically%20for%20acute%20pain%20management.%20Clinical%20studies%20on%20use%20of%20alpha-2%20agonists%20for%20acute%20pain%20management%20are%20reviewed%20and%20discussed.%20A%20literature%20search%20was%20done%20using%20Medline%20with%20the%20keywords%20%27alpha-2%20agonist%27%2C%20%27clonidine%27%2C%20%27dexmedetomidine%27%2C%20%27fadolmidine%27%2C%20%27pharmacokinetics%27%2C%20%27pharmacodynamics%27%2C%20%27postoperative%20analgesia%27%2C%20%27epidural%27%2C%20%27intrathecal%27%2C%20%27peripheral%20nerve%20block%27%20and%20various%20combinations%20with%20these%20keywords.%20The%20years%201977%20-%202009%20have%20been%20included%2C%20with%20particular%20focus%20on%20clinical%20studies%20from%20between%201990%20and%202009.%5Cn%5Cn%5CnWHAT%20THE%20READER%20WILL%20GAIN%5Cn%5CnThis%20article%20helps%20to%20clarify%20the%20clinical%20use%20of%20alpha-2%20agonists%20in%20acute%20pain%20management%20according%20to%20current%2C%20up-to-date%20evidence.%20Clinically%2C%20available%20alpha-2%20agonists%2C%20including%20clonidine%20and%20dexmedetomidine%2C%20are%20discussed%20in%20detail.%5Cn%5Cn%5CnTAKE%20HOME%20MESSAGE%5Cn%5CnAlpha-2%20agonists%2C%20especially%20clonidine%2C%20seem%20to%20be%20promising%20with%20regard%20to%20acute%20postoperative%20pain%20management.%20However%2C%20more%20clinical%20evidence%20on%20dexmedetomidine%20is%20necessary%20to%20confirm%20its%20definite%20role%20in%20acute%20postoperative%20pain%20control.%22%2C%22date%22%3A%22Dec%202010%22%2C%22language%22%3A%22%22%2C%22DOI%22%3A%2210.1517%5C%2F14656566.2010.511613%22%2C%22ISSN%22%3A%221744-7666%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22KVDVSTPT%22%2C%22REGTAX4T%22%5D%2C%22dateModified%22%3A%222013-02-06T14%3A36%3A14Z%22%7D%7D%2C%7B%22key%22%3A%224Q2HSF4R%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Oddby-Muhrbeck%20et%20al.%22%2C%22parsedDate%22%3A%222002-05%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%3EOddby-Muhrbeck%2C%20E.%2C%20Eksborg%2C%20S.%2C%20Bergendahl%2C%20H.%20T.%20G.%2C%20Muhrbeck%2C%20O.%2C%20%26amp%3B%20L%26%23xF6%3Bnnqvist%2C%20P.%20A.%20%282002%29.%20Effects%20of%20clonidine%20on%20postoperative%20nausea%20and%20vomiting%20in%20breast%20cancer%20surgery.%20%3Ci%3EAnesthesiology%3C%5C%2Fi%3E%2C%20%3Ci%3E96%3C%5C%2Fi%3E%285%29%2C%201109%26%23x2013%3B1114.%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Effects%20of%20clonidine%20on%20postoperative%20nausea%20and%20vomiting%20in%20breast%20cancer%20surgery%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Eva%22%2C%22lastName%22%3A%22Oddby-Muhrbeck%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Staffan%22%2C%22lastName%22%3A%22Eksborg%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Henrik%20T%20G%22%2C%22lastName%22%3A%22Bergendahl%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Olle%22%2C%22lastName%22%3A%22Muhrbeck%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Per%20Arne%22%2C%22lastName%22%3A%22L%5Cu00f6nnqvist%22%7D%5D%2C%22abstractNote%22%3A%22BACKGROUND%5Cn%5CnPostoperative%20nausea%20and%20vomiting%20%28PONV%29%20is%20still%20common%2C%20especially%20among%20female%20patients.%20Our%20hypothesis%20is%20that%20coinduction%20with%20clonidine%20reduces%20the%20incidence%20of%20PONV%20in%20adult%20patients%20undergoing%20breast%20cancer%20surgery.%5Cn%5Cn%5CnMETHODS%5Cn%5CnSixty-eight%20women%20premedicated%20with%20midazolam%20were%20randomly%20allocated%20to%20coinduction%20with%20intravenous%20clonidine%20%28group%20C%29%20or%20placebo%20%28group%20P%29%20in%20this%20prospective%2C%20double-blind%20study.%20Anesthesia%20was%20standardized%20%28laryngeal%20mask%20airway%2C%20fentanyl%2C%20propofol%2C%20sevoflurane%2C%20nitrous%20oxide%2C%20and%20oxygen%29.%20Hemodynamic%20parameters%20and%20the%20requirements%20for%20propofol%2C%20sevoflurane%2C%20and%20the%20postoperative%20need%20for%20ketobemidone%20were%20noted.%20The%20primary%20endpoints%20studied%20were%20the%20number%20of%20PONV-free%20patients%20and%20patient%20satisfaction%20with%20respect%20to%20PONV.%5Cn%5Cn%5CnRESULTS%5Cn%5CnPatients%20in%20group%20C%20had%20a%20significantly%20reduced%20need%20for%20propofol%20%28P%20%3C%200.04%29%20and%20sevoflurane%20%28P%20%3C%200.01%29%20and%20a%20reduced%20early%20need%20for%20ketobemidone%20%28P%20%3C%200.04%29.%20There%20were%20significantly%20more%20PONV-free%20patients%20in%20group%20C%20compared%20with%20group%20P%20%2820%20and%2011%20of%2030%2C%20respectively%3B%20P%20%3C%200.04%29.%20The%20number%20needed%20to%20treat%20was%203.3%20%2895%25%20confidence%20interval%2C%201.8%2C%2016.9%29.%20Intraoperative%20blood%20pressure%2C%20postoperative%20heart%20rate%2C%20and%20postoperative%20blood%20pressure%20were%20all%20significantly%20lower%20in%20group%20C%20compared%20with%20group%20P%2C%20but%20were%20not%20considered%20to%20be%20of%20clinical%20importance.%20No%20negative%20side%20effects%20were%20recorded.%5Cn%5Cn%5CnCONCLUSION%5Cn%5CnCoinduction%20with%20clonidine%20significantly%20increased%20the%20number%20of%20PONV-free%20patients%20after%20breast%20cancer%20surgery%20with%20general%20anesthesia.%22%2C%22date%22%3A%22May%202002%22%2C%22language%22%3A%22%22%2C%22DOI%22%3A%22%22%2C%22ISSN%22%3A%220003-3022%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22AN4T54B3%22%2C%22REGTAX4T%22%5D%2C%22dateModified%22%3A%222013-02-06T14%3A20%3A47Z%22%7D%7D%2C%7B%22key%22%3A%22TGW4DVDV%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Taheri%20et%20al.%22%2C%22parsedDate%22%3A%222010-06%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%3ETaheri%2C%20A.%2C%20Javadimanesh%2C%20M.%20A.%2C%20%26amp%3B%20Ashraf%2C%20H.%20%282010%29.%20The%20effect%20of%20oral%20clonidine%20premedication%20on%20nausea%20and%20vomiting%20after%20ear%20surgery.%20%3Ci%3EMiddle%20East%20Journal%20of%20Anesthesiology%3C%5C%2Fi%3E%2C%20%3Ci%3E20%3C%5C%2Fi%3E%285%29%2C%20691%26%23x2013%3B694.%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22The%20effect%20of%20oral%20clonidine%20premedication%20on%20nausea%20and%20vomiting%20after%20ear%20surgery%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Arman%22%2C%22lastName%22%3A%22Taheri%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Mohammad%20Ali%22%2C%22lastName%22%3A%22Javadimanesh%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Haleh%22%2C%22lastName%22%3A%22Ashraf%22%7D%5D%2C%22abstractNote%22%3A%22OBJECTIVE%5Cn%5CnPostoperative%20nausea%20and%20vomiting%20%28PONV%29%20is%20a%20most%20distressing%20adverse%20event%20for%20surgical%20patients%20with%20a%20considerable%20economic%20impact%20.The%20aim%20of%20the%20present%20study%20was%20to%20evaluate%20the%20effect%20of%20clonidine%20given%20orally%20for%20PONV%20in%20patients%20undergoing%20anesthesia%20for%20outpatient%20ear%20surgery.%5Cn%5Cn%5CnMETHODS%5Cn%5CnSixty%20patients%2030.2%20%2B%5C%2F-%209.9%20years%2C%20scheduled%20for%20ear%20surgery%2C%20were%20randomly%20assigned%20to%20one%20of%20two%20groups%20%28clonidine%20or%20placebo%29%20in%20a%20double-blinded%20manner.%20Anesthesia%20was%20standardized%20laryngeal%20mask%20airway%2C%20fentanyl%2C%20propofol%2C%20halothane%2C%20nitrous%20oxide.%5Cn%5Cn%5CnRESULTS%5Cn%5CnA%20complete%20response%2C%20defined%20as%20no%20PONV%20and%20no%20need%20for%20rescue%20antiemetic%20medication%2C%20during%20the%20first%2024%20h%20after%20anesthesia%20was%2033%25%20with%20placebo%20and%2067%25%20with%20clonidine%2C%20respectively%20%28P.%200.01%29.%20No%20clinically%20adverse%20event%20was%20observed%20in%20any%20of%20the%20groups.%5Cn%5Cn%5CnCONCLUSION%5Cn%5CnOral%20premedication%20with%20clonidine%20reduced%20the%20rate%20of%20PONV%20in%20patients%20undergoing%20outpatient%20ear%20surgery.%22%2C%22date%22%3A%22Jun%202010%22%2C%22language%22%3A%22%22%2C%22DOI%22%3A%22%22%2C%22ISSN%22%3A%220544-0440%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22AN4T54B3%22%2C%22REGTAX4T%22%5D%2C%22dateModified%22%3A%222013-02-06T14%3A20%3A31Z%22%7D%7D%2C%7B%22key%22%3A%22KKEAWGPT%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Hamaya%20et%20al.%22%2C%22parsedDate%22%3A%221994-10%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%3EHamaya%2C%20Y.%2C%20Nishikawa%2C%20T.%2C%20%26amp%3B%20Dohi%2C%20S.%20%281994%29.%20Diuretic%20effect%20of%20clonidine%20during%20isoflurane%2C%20nitrous%20oxide%2C%20and%20oxygen%20anesthesia.%20%3Ci%3EAnesthesiology%3C%5C%2Fi%3E%2C%20%3Ci%3E81%3C%5C%2Fi%3E%284%29%2C%20811%26%23x2013%3B819.%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Diuretic%20effect%20of%20clonidine%20during%20isoflurane%2C%20nitrous%20oxide%2C%20and%20oxygen%20anesthesia%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Y%22%2C%22lastName%22%3A%22Hamaya%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22T%22%2C%22lastName%22%3A%22Nishikawa%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22S%22%2C%22lastName%22%3A%22Dohi%22%7D%5D%2C%22abstractNote%22%3A%22BACKGROUND%5Cn%5CnBecause%20clonidine%2C%20a%20relative%20selective%20alpha%202-agonist%2C%20inhibits%20the%20action%20of%20arginine%20vasopressin%20%28AVP%29%2C%20the%20authors%20examined%20whether%20clonidine%20as%20an%20oral%20preanesthetic%20medication%20would%20induce%20diuresis%20and%20also%20would%20affect%20AVP%20release%20and%20its%20action%20during%20general%20anesthesia.%5Cn%5Cn%5CnMETHODS%5Cn%5CnFifty-seven%20patients%20%28aged%2018-65%20yr%29%20randomly%20received%20oral%20clonidine%20either%20approximately%205%20micrograms.kg-1%20%28n%20%3D%2019%29%2C%20approximately%202.5%20micrograms.kg-1%20%28n%20%3D%2019%29%2C%20or%20none%20%28n%20%3D%2019%29%20in%20addition%20to%20oral%20famotidine%2020%20mg%2C%2090%20min%20before%20arrival%20at%20operating%20room.%20Urine%20volume%2C%20urine%20osmolality%2C%20and%20amount%20of%20sodium%20and%20potassium%20excreted%20into%20urine%20were%20examined%20every%20hour%20for%203%20h%20during%20minor%20surgery%20under%20general%20anesthesia%20with%20isoflurane%20and%20nitrous%20oxide%20in%20oxygen.%20For%205%20patients%20of%20each%20group%2C%20plasma%20AVP%20and%20atrial%20natriuretic%20peptide%20concentrations%20and%20urine%20cyclic%20adenosine%20monophosphate%20concentrations%20as%20an%20index%20of%20AVP%20action%20were%20also%20assayed.%5Cn%5Cn%5CnRESULTS%5Cn%5CnUrine%20output%20indices%20%28calculated%20as%20hourly%20urine%20output%20%5Bmilliliters%20per%20hour%5D%20divided%20by%20body%20weight%20%5Bkilograms%5D%29%20were%20significantly%20greater%20in%20the%20all%20periods%20%28P%20%3C%20or%20%3D%200.035%29%20after%20the%20initiation%20of%20anesthesia%20in%20the%20patients%20receiving%20clonidine%205%20micrograms.kg-1%20and%20only%20in%20the%203rd%20h%20in%20those%20receiving%20clonidine%202.5%20micrograms.kg-1%20%28P%20%3D%200.047%29%20as%20compared%20with%20those%20in%20the%20patients%20given%20famotidine%20alone.%20The%20peak%20effects%20of%20diuresis%20and%20natriuresis%20induced%20by%20oral%20clonidine%205%20micrograms.kg-1%20were%20both%20observed%20at%20the%202nd%20h%20%28mean%20%2B%5C%2F-%20SEM%2C%202.4%20%2B%5C%2F-%200.4%20ml.kg-1.h-1%20and%205.7%20%2B%5C%2F-%201.5%20mEq.h-1%20vs.%200.6%20%2B%5C%2F-%200.1%20ml.kg-1.h-1%20and%202.2%20%2B%5C%2F-%200.5%20mEq.h-1%20in%20the%20control%20subjects%3B%20P%20%3D%200.001%20and%20P%20%3D%200.049%29.%20Kaliuresis%20also%20increased%20in%20the%20patients%20receiving%20clonidine%205%20micrograms.kg-1%20in%20the%202nd%20and%203rd%20h%20%28P%20%3C%20or%20%3D%200.003%29.%20Urine%20osmolality%20showed%20a%20significant%20reduction%20over%20time%20in%20patients%20given%20clonidine%20but%20not%20in%20the%20control%20subjects.%20However%2C%20plasma%20AVP%20and%20atrial%20natriuretic%20peptide%20levels%2C%20and%20urine%20cyclic%20adenosine%20monophosphate%20concentrations%20did%20not%20significantly%20differ%20among%20the%20three%20groups.%5Cn%5Cn%5CnCONCLUSIONS%5Cn%5CnOral%20preanesthetic%20medication%20of%20clonidine%202.5%20or%205%20micrograms.kg-1%20caused%20a%20significant%20diuretic%20effect%20during%20surgery%20under%20general%20anesthesia%2C%20though%20it%20did%20not%20apparently%20relate%20to%20AVP%20action.%20This%20effect%20of%20clonidine%20could%20be%20related%20to%20its%20pharmacological%20action%20as%20an%20alpha%202-adrenoceptor%20agonist%20not%20necessarily%20restricted%20to%20the%20kidney.%20The%20diuretic%20effect%20of%20clonidine%20implicates%20its%20clinical%20importance%20in%20the%20management%20of%20patients%20during%20anesthesia.%22%2C%22date%22%3A%22Oct%201994%22%2C%22language%22%3A%22%22%2C%22DOI%22%3A%22%22%2C%22ISSN%22%3A%220003-3022%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22REGTAX4T%22%5D%2C%22dateModified%22%3A%222013-02-06T14%3A17%3A01Z%22%7D%7D%2C%7B%22key%22%3A%22NEATSN2D%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Mertes%20et%20al.%22%2C%22parsedDate%22%3A%221996-02%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%3EMertes%2C%20N.%2C%20Goeters%2C%20C.%2C%20Kuhmann%2C%20M.%2C%20%26amp%3B%20Zander%2C%20J.%20F.%20%281996%29.%20Postoperative%20alpha%202-adrenergic%20stimulation%20attenuates%20protein%20catabolism.%20%3Ci%3EAnesthesia%20and%20Analgesia%3C%5C%2Fi%3E%2C%20%3Ci%3E82%3C%5C%2Fi%3E%282%29%2C%20258%26%23x2013%3B263.%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Postoperative%20alpha%202-adrenergic%20stimulation%20attenuates%20protein%20catabolism%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22N%22%2C%22lastName%22%3A%22Mertes%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22C%22%2C%22lastName%22%3A%22Goeters%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22M%22%2C%22lastName%22%3A%22Kuhmann%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22J%20F%22%2C%22lastName%22%3A%22Zander%22%7D%5D%2C%22abstractNote%22%3A%22The%20metabolic%20effects%20of%20continuous%20intravenous%20%28IV%29%20application%20of%20the%20alpha%202%20agonist%20clonidine%20were%20evaluated%20by%20assessment%20of%20nitrogen%20economy%20and%20postaggression%20endocrine%20patterns.%20Twenty-four%20patients%20undergoing%20abdominothoracic%20esophageal%20cancer%20resection%20were%20studied.%20Thirteen%20of%20these%20patients%20with%20alcohol%20abuse%20were%20treated%20postoperatively%20with%20IV%20clonidine%20for%20prevention%20of%20alcohol%20withdrawal%20syndrome.%20Eleven%20patients%20who%20were%20not%20treated%20with%20clonidine%20served%20as%20controls.%20All%20patients%20were%20treated%20in%20a%20standardized%20manner%20in%20regard%20to%20surgical%20technique%2C%20balanced%20anesthesia%2C%20and%20postoperative%20intensive%20care%20treatment%2C%20including%20thoracic%20epidural%20analgesia%20with%20bupivacaine%20and%20fentanyl.%20Isonitrogenous%20and%20isocaloric%20nutrition%20was%20comparable%20in%20all%20patients.%20A%20significantly%20improved%20cumulated%206-day%20nitrogen%20balance%20was%20found%20in%20clonidine-treated%20patients%20%28-1.5%20%2B%5C%2F-%204.9%20g%20nitrogen%29%20compared%20to%20the%20control%20group%20%28-17.6%20%2B%5C%2F-%204.2%20g%20nitrogen%29%20%28P%20%3C%200.05%29.%20The%20main%20reason%20for%20improved%20nitrogen%20economy%20may%20be%20clonidine-induced%20growth%20hormone%20%28GH%29%20release.%20The%20pattern%20of%20insulin-like%20growth%20factor%20I%20%28IGF-I%29%20and%20insulin-like%20growth%20factor%20binding%20protein%203%20%28IGFBP-3%29%20concentrations%20could%20support%20this%20hypothesis.%22%2C%22date%22%3A%22Feb%201996%22%2C%22language%22%3A%22%22%2C%22DOI%22%3A%22%22%2C%22ISSN%22%3A%220003-2999%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22REGTAX4T%22%5D%2C%22dateModified%22%3A%222013-02-06T14%3A12%3A49Z%22%7D%7D%2C%7B%22key%22%3A%22TFK8B56Q%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Pichot%20et%20al.%22%2C%22parsedDate%22%3A%222012%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%3EPichot%2C%20C.%2C%20Longrois%2C%20D.%2C%20Ghignone%2C%20M.%2C%20%26amp%3B%20Quintin%2C%20L.%20%282012%29.%20Dexm%26%23xE9%3Bd%26%23xE9%3Btomidine%20et%20clonidine%26%23xA0%3B%3A%20revue%20de%20leurs%20propri%26%23xE9%3Bt%26%23xE9%3Bs%20pharmacodynamiques%20en%20vue%20de%20d%26%23xE9%3Bfinir%20la%20place%20des%20agonistes%20alpha-2%26%23xA0%3Badr%26%23xE9%3Bnergiques%20dans%20la%20s%26%23xE9%3Bdation%20en%20r%26%23xE9%3Banimation.%20%3Ci%3EAnnales%20Fran%26%23xE7%3Baises%20d%26%23x2019%3BAnesth%26%23xE9%3Bsie%20et%20de%20R%26%23xE9%3Banimation%3C%5C%2Fi%3E%2C%20%3Ci%3E31%3C%5C%2Fi%3E%2811%29%2C%20876%26%23x2013%3B896.%20%3Ca%20href%3D%27https%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1016%5C%2Fj.annfar.2012.07.018%27%3Ehttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1016%5C%2Fj.annfar.2012.07.018%3C%5C%2Fa%3E%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Dexm%5Cu00e9d%5Cu00e9tomidine%20et%20clonidine%5Cu00a0%3A%20revue%20de%20leurs%20propri%5Cu00e9t%5Cu00e9s%20pharmacodynamiques%20en%20vue%20de%20d%5Cu00e9finir%20la%20place%20des%20agonistes%20alpha-2%5Cu00a0adr%5Cu00e9nergiques%20dans%20la%20s%5Cu00e9dation%20en%20r%5Cu00e9animation%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22C.%22%2C%22lastName%22%3A%22Pichot%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22D.%22%2C%22lastName%22%3A%22Longrois%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22M.%22%2C%22lastName%22%3A%22Ghignone%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22L.%22%2C%22lastName%22%3A%22Quintin%22%7D%5D%2C%22abstractNote%22%3A%22%22%2C%22date%22%3A%2211%5C%2F2012%22%2C%22language%22%3A%22%22%2C%22DOI%22%3A%2210.1016%5C%2Fj.annfar.2012.07.018%22%2C%22ISSN%22%3A%2207507658%22%2C%22url%22%3A%22http%3A%5C%2F%5C%2Fwww.em-consulte.com%5C%2Farticle%5C%2F766726%5C%2Farticle%5C%2Fdexmedetomidine-et-clonidine-revue-de-leurs-propri%22%2C%22collections%22%3A%5B%222UUB4CMW%22%2C%22REGTAX4T%22%5D%2C%22dateModified%22%3A%222013-02-04T18%3A13%3A21Z%22%7D%7D%2C%7B%22key%22%3A%22DA99X2KI%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22De%20Kock%20et%20al.%22%2C%22parsedDate%22%3A%221997-02%22%2C%22numChildren%22%3A2%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%3EDe%20Kock%2C%20M.%2C%20Wiederkher%2C%20P.%2C%20Laghmiche%2C%20A.%2C%20%26amp%3B%20Scholtes%2C%20J.%20L.%20%281997%29.%20Epidural%20clonidine%20used%20as%20the%20sole%20analgesic%20agent%20during%20and%20after%20abdominal%20surgery.%20A%20dose-response%20study.%20%3Ci%3EAnesthesiology%3C%5C%2Fi%3E%2C%20%3Ci%3E86%3C%5C%2Fi%3E%282%29%2C%20285%26%23x2013%3B292.%20%3Ca%20href%3D%27http%3A%5C%2F%5C%2Fwww.ncbi.nlm.nih.gov%5C%2Fpubmed%5C%2F9054246%27%3Ehttp%3A%5C%2F%5C%2Fwww.ncbi.nlm.nih.gov%5C%2Fpubmed%5C%2F9054246%3C%5C%2Fa%3E%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Epidural%20clonidine%20used%20as%20the%20sole%20analgesic%20agent%20during%20and%20after%20abdominal%20surgery.%20A%20dose-response%20study%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22M%22%2C%22lastName%22%3A%22De%20Kock%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22P%22%2C%22lastName%22%3A%22Wiederkher%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22A%22%2C%22lastName%22%3A%22Laghmiche%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22J%20L%22%2C%22lastName%22%3A%22Scholtes%22%7D%5D%2C%22abstractNote%22%3A%22BACKGROUND%5Cn%5CnMany%20studies%20have%20shown%20the%20beneficial%20effect%20of%20epidural%20clonidine%20in%20postoperative%20pain%20management.%20In%20these%20studies%2C%20the%20patients%20received%20local%20anesthetics%2C%20opioids%2C%20or%20both%20in%20combination%20with%20clonidine.%20Due%20to%20the%20interactive%20potentiation%20of%20those%20drugs%2C%20the%20importance%20of%20the%20intrinsic%20analgesic%20properties%20of%20the%20alpha%202-adrenoceptor%20agonist%20is%20difficult%20to%20establish.%20The%20authors%20investigated%20the%20analgesic%20potency%20of%20epidural%20clonidine%20when%20used%20as%20the%20sole%20analgesic%20agent%20during%20and%20after%20major%20abdominal%20surgery.%5Cn%5Cn%5CnMETHODS%5Cn%5CnFifty%20young%20adult%20patients%20undergoing%20intestinal%20surgery%20under%20general%20anesthesia%20with%20propofol%20were%20studied.%20At%20induction%2C%20the%20patients%20received%20epidurally%20either%20an%20initial%20dose%20of%202%20micrograms%5C%2Fkg%20clonidine%20followed%20by%20an%20infusion%20of%200.5%20microgram.kg-1.h-1%20%28group%201%2C%20n%20%3D%2010%29%20or%204%20micrograms%5C%2Fkg%20followed%20by%201%20microgram.kg-1.h-1%20%28group%202%2C%20n%20%3D%2020%29%20or%208%20micrograms.kg-1.h-1%20followed%20by%20an%20infusion%20of%202%20micrograms.kg-1.h-1%20%28group%203%2C%20n%20%3D%2020%29.%20During%20the%20operation%2C%20increases%20in%20arterial%20blood%20pressure%20or%20heart%20rate%20that%20did%20not%20respond%20to%20a%20propofol%20bolus%20%280.5%20mg%5C%2Fkg%29%20were%20treated%20with%20a%20bolus%20of%20intravenous%20lidocaine%20%281%20mg%5C%2Fkg%29.%20Three%20successive%20injections%20were%20allowed.%20When%20baseline%20values%20were%20not%20restored%2C%20opioids%20were%20added%20and%20the%20patient%20was%20removed%20from%20the%20study.%20After%20operation%2C%20the%20clonidine%20infusions%20were%20maintained%20for%2012%20h.%20During%20this%20period%20and%20at%20every%2030%20min%2C%20sedation%20scores%20and%20visual%20analog%20scale%20values%20at%20rest%20and%20at%20cough%20were%20noted.%20In%20case%20of%20subjective%20scores%20up%20to%205%20cm%20at%20rest%20or%20up%20to%208%20cm%20at%20cough%2C%20the%20patients%20were%20given%20access%20to%20a%20patient-controlled%20analgesia%20device%20that%20delivered%20epidural%20bupivacaine.%20The%20end%20point%20of%20the%20study%20was%20reached%20once%20the%20patient%20activated%20the%20analgesic%20delivery%20button.%5Cn%5Cn%5CnRESULTS%5Cn%5CnDuring%20surgery%2C%2060%25%20of%20patients%20in%20group%201%20compared%20with%2033%25%20of%20patients%20in%20group%202%20and%20only%205%25%20of%20patients%20in%20group%203%20were%20removed%20from%20the%20study%20protocol%20because%20of%20inadequate%20anesthesia%20%28P%20%3C%200.05%29.%20After%20operation%2C%20epidural%20clonidine%20provided%20complete%20analgesia%20lasting%2030%20%2B%5C%2F-%2021%20min%20in%20group%201%20compared%20with%20251%20%2B%5C%2F-%20237%20min%20in%20group%202%20or%20369%20%2B%5C%2F-%20256%20min%20in%20group%203%20%28P%20%3C%200.05%20for%20group%201%20vs.%20groups%202%20and%203%20and%20group%202%20vs.%20group%203%29.%5Cn%5Cn%5CnCONCLUSIONS%5Cn%5CnEpidural%20clonidine%20used%20as%20the%20sole%20analgesic%20agent%20provided%20dose-dependent%20control%20of%20the%20hemodynamic%20changes%20associated%20with%20surgical%20stimulation.%20It%20also%20produced%20dose-dependent%20postoperative%20analgesia%20without%20major%20side%20effects.%22%2C%22date%22%3A%22Feb%201997%22%2C%22language%22%3A%22%22%2C%22DOI%22%3A%22%22%2C%22ISSN%22%3A%220003-3022%22%2C%22url%22%3A%22http%3A%5C%2F%5C%2Fwww.ncbi.nlm.nih.gov%5C%2Fpubmed%5C%2F9054246%22%2C%22collections%22%3A%5B%222WRS5ZHU%22%2C%2233MVZNNS%22%2C%22REGTAX4T%22%5D%2C%22dateModified%22%3A%222013-01-25T05%3A57%3A57Z%22%7D%7D%2C%7B%22key%22%3A%226T73TWAZ%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22St%5Cu00fchmeier%20et%20al.%22%2C%22parsedDate%22%3A%221996-10%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%3ESt%26%23xFC%3Bhmeier%2C%20K.%20D.%2C%20Mainzer%2C%20B.%2C%20Cierpka%2C%20J.%2C%20Sandmann%2C%20W.%2C%20%26amp%3B%20Tarnow%2C%20J.%20%281996%29.%20Small%2C%20oral%20dose%20of%20clonidine%20reduces%20the%20incidence%20of%20intraoperative%20myocardial%20ischemia%20in%20patients%20having%20vascular%20surgery.%20%3Ci%3EAnesthesiology%3C%5C%2Fi%3E%2C%20%3Ci%3E85%3C%5C%2Fi%3E%284%29%2C%20706%26%23x2013%3B712.%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Small%2C%20oral%20dose%20of%20clonidine%20reduces%20the%20incidence%20of%20intraoperative%20myocardial%20ischemia%20in%20patients%20having%20vascular%20surgery%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22K%20D%22%2C%22lastName%22%3A%22St%5Cu00fchmeier%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22B%22%2C%22lastName%22%3A%22Mainzer%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22J%22%2C%22lastName%22%3A%22Cierpka%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22W%22%2C%22lastName%22%3A%22Sandmann%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22J%22%2C%22lastName%22%3A%22Tarnow%22%7D%5D%2C%22abstractNote%22%3A%22BACKGROUND%5Cn%5CnMost%20new%20perioperative%20myocardial%20ischemic%20episodes%20occur%20in%20the%20absence%20of%20hypertension%20or%20tachycardia.%20The%20ability%20of%20alpha%202-adrenoceptor%20agonists%20to%20inhibit%20central%20sympathetic%20outflow%20may%20benefit%20patients%20with%20coronary%20artery%20disease%20by%20increasing%20the%20myocardial%20oxygen%20supply%20and%20-demand%20ratio.%5Cn%5Cn%5CnMETHODS%5Cn%5CnA%20randomized%20double-blind%20study%20design%20was%20used%20in%20297%20patients%20scheduled%20to%20have%20elective%20vascular%20surgical%20procedures%20to%20evaluate%20the%20effects%20of%202%20micrograms%5C%2Fkg-1%20oral%20clonidine%20%28n%20%3D%20145%29%20or%20placebo%20%28n%20%3D%20152%29%20on%20the%20incidence%20of%20perioperative%20myocardial%20ischemic%20episodes%2C%20myocardial%20infarction%2C%20and%20cardiac%20death.%20Continuous%20real-time%20S-T%20segment%20trend%20analysis%20%28lead%20II%20and%20V5%29%20was%20performed%20during%20anesthesia%20and%20surgery%20and%20correlated%20with%20arterial%20blood%20pressure%20and%20heart%20rate%20before%20and%20during%20ischemic%20events.%20Dose%20requirements%20for%20vasoactive%20and%20antiischemic%20drugs%20to%20control%20blood%20pressure%20and%20heart%20rate%20as%20well%20as%20episodes%20of%20myocardial%20ischemia%20%28i.e.%2C%20catecholamines%2C%20beta-adrenoceptor%20antagonists%2C%20nitrates%2C%20and%20systemic%20vasodilators%29%20and%20fluid%20volume%20load%20were%20recorded.%5Cn%5Cn%5CnRESULTS%5Cn%5CnAdministration%20of%20clonidine%20reduced%20the%20incidence%20of%20perioperative%20myocardial%20ischemic%20episodes%20from%2039%25%20%2859%20of%20152%29%20to%2024%25%20%2835%20of%20145%29%20%28P%20%3C%200.01%29.%20Hemodynamic%20patterns%2C%20percentage%20of%20ischemic%20time%2C%20and%20the%20number%20of%20ischemic%20episodes%20per%20patient%20did%20not%20differ.%20Nonfatal%20myocardial%20infarction%20developed%20after%20operation%20in%20four%20patients%20receiving%20placebo%20compared%20with%20none%20receiving%20clonidine%20%28day%202%20to%2021%3B%20P%20%3D%200.07%29.%20The%20incidence%20of%20fatal%20cardiac%20events%20%281%20vs.%202%29%20was%20not%20different.%20Dose%20requirements%20for%20vasoactive%20and%20antiischemic%20drugs%20did%20not%20differ%20between%20the%20groups%2C%20but%20the%20amount%20of%20presurgical%20fluid%20volume%20was%20slightly%20greater%20in%20patients%20receiving%20clonidine%20%28951%20%2B%5C%2F-%20388%20vs.%20867%20%2B%5C%2F-%20381%20ml%3B%20P%20%3C%200.03%29.%5Cn%5Cn%5CnCONCLUSION%5Cn%5CnA%20small%20oral%20dose%20of%20clonidine%2C%20given%20prophylactically%2C%20can%20reduce%20the%20incidence%20of%20perioperative%20myocardial%20ischemic%20episodes%20without%20affecting%20hemodynamic%20stability%20in%20patients%20with%20suspected%20or%20documented%20coronary%20artery%20disease.%22%2C%22date%22%3A%22Oct%201996%22%2C%22language%22%3A%22%22%2C%22DOI%22%3A%22%22%2C%22ISSN%22%3A%220003-3022%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22REGTAX4T%22%5D%2C%22dateModified%22%3A%222013-01-22T08%3A51%3A37Z%22%7D%7D%2C%7B%22key%22%3A%22J5RJTKBE%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Scheinin%20et%20al.%22%2C%22parsedDate%22%3A%221998-09%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%3EScheinin%2C%20H.%2C%20Aantaa%2C%20R.%2C%20Anttila%2C%20M.%2C%20Hakola%2C%20P.%2C%20Helminen%2C%20A.%2C%20%26amp%3B%20Karhuvaara%2C%20S.%20%281998%29.%20Reversal%20of%20the%20sedative%20and%20sympatholytic%20effects%20of%20dexmedetomidine%20with%20a%20specific%20alpha2-adrenoceptor%20antagonist%20atipamezole%3A%20a%20pharmacodynamic%20and%20kinetic%20study%20in%20healthy%20volunteers.%20%3Ci%3EAnesthesiology%3C%5C%2Fi%3E%2C%20%3Ci%3E89%3C%5C%2Fi%3E%283%29%2C%20574%26%23x2013%3B584.%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Reversal%20of%20the%20sedative%20and%20sympatholytic%20effects%20of%20dexmedetomidine%20with%20a%20specific%20alpha2-adrenoceptor%20antagonist%20atipamezole%3A%20a%20pharmacodynamic%20and%20kinetic%20study%20in%20healthy%20volunteers%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22H%22%2C%22lastName%22%3A%22Scheinin%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22R%22%2C%22lastName%22%3A%22Aantaa%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22M%22%2C%22lastName%22%3A%22Anttila%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22P%22%2C%22lastName%22%3A%22Hakola%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22A%22%2C%22lastName%22%3A%22Helminen%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22S%22%2C%22lastName%22%3A%22Karhuvaara%22%7D%5D%2C%22abstractNote%22%3A%22BACKGROUND%5Cn%5CnSpecific%20and%20selective%20alpha2-adrenergic%20drugs%20are%20widely%20exploited%20in%20veterinary%20anesthesiology.%20Because%20alpha2-agonists%20are%20also%20being%20introduced%20to%20human%20practice%2C%20the%20authors%20studied%20reversal%20of%20a%20clinically%20relevant%20dexmedetomidine%20dose%20with%20atipamezole%2C%20an%20alpha2-antagonist%2C%20in%20healthy%20persons.%5Cn%5Cn%5CnMETHODS%5Cn%5CnThe%20study%20consisted%20of%20two%20parts.%20In%20an%20open%20dose-finding%20study%20%28part%201%29%2C%20the%20intravenous%20dose%20of%20atipamezole%20to%20reverse%20the%20sedative%20effects%20of%202.5%20microg%5C%2Fkg%20of%20dexmedetomidine%20given%20intramuscularly%20was%20determined%20%28n%20%3D%206%29.%20Part%202%20was%20a%20placebo-controlled%2C%20double-blinded%2C%20randomized%20cross-over%20study%20in%20which%20three%20doses%20of%20atipamezole%20%2815%2C%2050%2C%20and%20150%20microg%5C%2Fkg%20given%20intravenously%20in%202%20min%29%20or%20saline%20were%20administered%201%20h%20after%20dexmedetomidine%20at%201-week%20intervals%20%28n%20%3D%208%29.%20Subjective%20vigilance%20and%20anxiety%2C%20psychomotor%20performance%2C%20hemodynamics%2C%20and%20saliva%20secretion%20were%20determined%2C%20and%20plasma%20catecholamines%20and%20serum%20drug%20concentrations%20were%20measured%20for%207%20h.%5Cn%5Cn%5CnRESULTS%5Cn%5CnThe%20mean%20%2B%5C%2F-%20SD%20atipamezole%20dose%20needed%20in%20part%201%20was%20104%2B%5C%2F-44%20microg%5C%2Fkg.%20In%20part%202%2C%20dexmedetomidine%20induced%20clear%20impairments%20of%20vigilance%20and%20psychomotor%20performance%20that%20were%20dose%20dependently%20reversed%20by%20atipamezole%20%28P%20%3C%200.001%29.%20Complete%20resolution%20of%20sedation%20was%20evident%20after%20the%20highest%20%28150%20microg%5C%2Fkg%29%20dose%2C%20and%20the%20degree%20of%20vigilance%20remained%20high%20for%207%20h.%20Atipamezole%20dose%20dependently%20reversed%20the%20reductions%20in%20blood%20pressure%20%28P%20%3C%200.001%29%20and%20heart%20rate%20%28P%20%3D%200.009%29.%20Changes%20in%20saliva%20secretion%20and%20plasma%20catecholamines%20were%20similarly%20biphasic%20%28i.e.%2C%20they%20decreased%20after%20dexmedetomidine%20followed%20by%20dose-dependent%20restoration%20after%20atipamezole%29.%20Plasma%20norepinephrine%20levels%20were%2C%20however%2C%20increased%20considerably%20after%20the%20150%20microg%5C%2Fkg%20dose%20of%20atipamezole.%20The%20pharmacokinetics%20of%20atipamezole%20were%20linear%2C%20and%20elimination%20half-lives%20for%20both%20drugs%20were%20approximately%202%20h.%20Atipamezole%20did%20not%20affect%20the%20disposition%20of%20dexmedetomidine.%20One%20person%20had%20symptomatic%20sinus%20arrest%2C%20and%20another%20had%20transient%20bradycardia%20approximately%203%20h%20after%20receiving%20dexmedetomidine.%5Cn%5Cn%5CnCONCLUSIONS%5Cn%5CnThe%20sedative%20and%20sympatholytic%20effects%20of%20intramuscular%20dexmedetomidine%20were%20dose%20dependently%20antagonized%20by%20intravenous%20atipamezole.%20The%20applied%20infusion%20rate%20%2875%20microg%20x%20kg%28-1%29%20x%20min%28-1%29%29%20for%20the%20highest%20atipamezole%20dose%20was%2C%20however%2C%20too%20fast%2C%20as%20evident%20by%20transient%20sympathoactivation.%20Similar%20elimination%20half-lives%20of%20these%20two%20drugs%20are%20a%20clear%20advantage%20considering%20the%20possible%20clinical%20applications.%22%2C%22date%22%3A%22Sep%201998%22%2C%22language%22%3A%22%22%2C%22DOI%22%3A%22%22%2C%22ISSN%22%3A%220003-3022%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22REGTAX4T%22%5D%2C%22dateModified%22%3A%222013-01-22T08%3A42%3A10Z%22%7D%7D%2C%7B%22key%22%3A%22U5IHCDIC%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Talke%22%2C%22parsedDate%22%3A%221998-09%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%3ETalke%2C%20P.%20%281998%29.%20Receptor-specific%20reversible%20sedation%3A%20beginning%20of%20new%20era%20of%20anesthesia%3F%20%3Ci%3EAnesthesiology%3C%5C%2Fi%3E%2C%20%3Ci%3E89%3C%5C%2Fi%3E%283%29%2C%20560%26%23x2013%3B561.%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Receptor-specific%20reversible%20sedation%3A%20beginning%20of%20new%20era%20of%20anesthesia%3F%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22P%22%2C%22lastName%22%3A%22Talke%22%7D%5D%2C%22abstractNote%22%3A%22%22%2C%22date%22%3A%22Sep%201998%22%2C%22language%22%3A%22%22%2C%22DOI%22%3A%22%22%2C%22ISSN%22%3A%220003-3022%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22REGTAX4T%22%5D%2C%22dateModified%22%3A%222013-01-22T08%3A42%3A10Z%22%7D%7D%2C%7B%22key%22%3A%22CSHN6E84%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Park%20et%20al.%22%2C%22parsedDate%22%3A%222012%22%2C%22numChildren%22%3A2%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%3EPark%2C%20S.%20M.%2C%20Mangat%2C%20H.%20S.%2C%20Berger%2C%20K.%2C%20%26amp%3B%20Rosengart%2C%20A.%20J.%20%282012%29.%20Efficacy%20spectrum%20of%20antishivering%20medications.%20%3Ci%3ECritical%20Care%20Medicine%3C%5C%2Fi%3E%2C%20%3Ci%3E40%3C%5C%2Fi%3E%2811%29%2C%203070%26%23x2013%3B3082.%20%3Ca%20href%3D%27https%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1097%5C%2FCCM.0b013e31825b931e%27%3Ehttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1097%5C%2FCCM.0b013e31825b931e%3C%5C%2Fa%3E%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Efficacy%20spectrum%20of%20antishivering%20medications%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Sea%20Mi%22%2C%22lastName%22%3A%22Park%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Halinder%20S.%22%2C%22lastName%22%3A%22Mangat%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Karen%22%2C%22lastName%22%3A%22Berger%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Axel%20J.%22%2C%22lastName%22%3A%22Rosengart%22%7D%5D%2C%22abstractNote%22%3A%22%22%2C%22date%22%3A%2211%5C%2F2012%22%2C%22language%22%3A%22%22%2C%22DOI%22%3A%2210.1097%5C%2FCCM.0b013e31825b931e%22%2C%22ISSN%22%3A%220090-3493%22%2C%22url%22%3A%22http%3A%5C%2F%5C%2Fjournals.lww.com%5C%2Fccmjournal%5C%2FAbstract%5C%2F2012%5C%2F11000%5C%2FEfficacy_spectrum_of_antishivering_medications__.19.aspx%22%2C%22collections%22%3A%5B%223T2GW26P%22%2C%22386Q23HD%22%5D%2C%22dateModified%22%3A%222013-01-15T11%3A37%3A09Z%22%7D%7D%2C%7B%22key%22%3A%224FUT74CA%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22P%5Cu00f6pping%20et%20al.%22%2C%22parsedDate%22%3A%222009-08%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%3EP%26%23xF6%3Bpping%2C%20D.%20M.%2C%20Elia%2C%20N.%2C%20Marret%2C%20E.%2C%20Wenk%2C%20M.%2C%20%26amp%3B%20Tram%26%23xE8%3Br%2C%20M.%20R.%20%282009%29.%20Clonidine%20as%20an%20adjuvant%20to%20local%20anesthetics%20for%20peripheral%20nerve%20and%20plexus%20blocks%3A%20a%20meta-analysis%20of%20randomized%20trials.%20%3Ci%3EAnesthesiology%3C%5C%2Fi%3E%2C%20%3Ci%3E111%3C%5C%2Fi%3E%282%29%2C%20406%26%23x2013%3B415.%20%3Ca%20href%3D%27https%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1097%5C%2FALN.0b013e3181aae897%27%3Ehttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1097%5C%2FALN.0b013e3181aae897%3C%5C%2Fa%3E%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Clonidine%20as%20an%20adjuvant%20to%20local%20anesthetics%20for%20peripheral%20nerve%20and%20plexus%20blocks%3A%20a%20meta-analysis%20of%20randomized%20trials%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Daniel%20M%22%2C%22lastName%22%3A%22P%5Cu00f6pping%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Nadia%22%2C%22lastName%22%3A%22Elia%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Emmanuel%22%2C%22lastName%22%3A%22Marret%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Manuel%22%2C%22lastName%22%3A%22Wenk%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Martin%20R%22%2C%22lastName%22%3A%22Tram%5Cu00e8r%22%7D%5D%2C%22abstractNote%22%3A%22The%20effect%20of%20adding%20clonidine%20to%20local%20anesthetics%20for%20nerve%20or%20plexus%20blocks%20remains%20unclear.%20The%20authors%20searched%20for%20randomized%20placebo-controlled%20trials%20testing%20the%20impact%20of%20adding%20clonidine%20to%20local%20anesthetics%20for%20peripheral%20single-injection%20nerve%20or%20plexus%20blocks%20in%20adults%20undergoing%20any%20surgery%20%28except%20eye%29%20without%20general%20anesthesia.%20Twenty%20trials%20%281%2C054%20patients%2C%20573%20received%20clonidine%29%20published%201992-2006%20tested%20plexus%20%2814%20brachial%2C%201%20cervical%29%20and%20nerve%20blocks%20%282%20sciatic%5C%2Ffemoral%2C%201%20midhumeral%2C%201%20ilioinguinal%5C%2Filiohypogastric%2C%201%20ankle%29.%20Clonidine%20doses%20ranged%20from%2030%20to%20300%20microg%3B%20most%20patients%20received%20150%20microg.%20Clonidine%20prolonged%20the%20duration%20of%20postoperative%20analgesia%20%28weighted%20mean%20difference%20122%20min%3B%2095%25%20confidence%20interval%20%5BCI%5D%2074-169%29%2C%20sensory%20block%20%28weighted%20mean%20difference%2074%20min%3B%2095%25%20CI%2037-111%29%2C%20and%20motor%20block%20%28weighted%20mean%20difference%20141%20min%3B%2095%25%20CI%2082-199%29.%20In%20a%20subgroup%20of%20patients%20receiving%20an%20axillary%20plexus%20block%2C%20these%20effects%20were%20independent%20of%20whether%20clonidine%20was%20added%20to%20an%20intermediate%20or%20a%20long-acting%20local%20anesthetic.%20Clonidine%20increased%20the%20risk%20of%20arterial%20hypotension%20%28odds%20ratio%203.61%3B%2095%25%20CI%201.52-8.55%3B%20number-needed-to-harm%2011%29%2C%20orthostatic%20hypotension%20or%20fainting%20%28odds%20ratio%205.07%3B%2095%25%20CI%201.20-21.4%3B%20number-needed-to-harm%2010%29%2C%20bradycardia%20%28odds%20ratio%203.09%3B%2095%25%20CI%201.10-8.64%3B%20number-needed-to-harm%2013%29%2C%20and%20sedation%20%28odds%20ratio%202.28%3B%2095%25%20CI%201.15-4.51%3B%20number-needed-to-harm%205%29.%20There%20was%20a%20lack%20of%20evidence%20of%20dose-responsiveness%20for%20beneficial%20or%20harmful%20effects.%20Clonidine%20added%20to%20intermediate%20or%20long-acting%20local%20anesthetics%20for%20single-shot%20peripheral%20nerve%20or%20plexus%20blocks%20prolongs%20duration%20of%20analgesia%20and%20motor%20block%20by%20about%202%20h.%20The%20increased%20risk%20of%20hypotension%2C%20fainting%2C%20and%20sedation%20may%20limit%20its%20usefulness.%20Dose-responsiveness%20remains%20unclear.%22%2C%22date%22%3A%22Aug%202009%22%2C%22language%22%3A%22%22%2C%22DOI%22%3A%2210.1097%5C%2FALN.0b013e3181aae897%22%2C%22ISSN%22%3A%221528-1175%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22GAJTTVTX%22%5D%2C%22dateModified%22%3A%222013-01-14T13%3A38%3A20Z%22%7D%7D%2C%7B%22key%22%3A%223NW5NTIM%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Dahmani%20et%20al.%22%2C%22parsedDate%22%3A%222010-04%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%3EDahmani%2C%20S.%2C%20Brasher%2C%20C.%2C%20Stany%2C%20I.%2C%20Golmard%2C%20J.%2C%20Skhiri%2C%20A.%2C%20Bruneau%2C%20B.%2C%20Nivoche%2C%20Y.%2C%20Constant%2C%20I.%2C%20%26amp%3B%20Murat%2C%20I.%20%282010%29.%20Premedication%20with%20clonidine%20is%20superior%20to%20benzodiazepines.%20A%20meta%20analysis%20of%20published%20studies.%20%3Ci%3EActa%20Anaesthesiologica%20Scandinavica%3C%5C%2Fi%3E%2C%20%3Ci%3E54%3C%5C%2Fi%3E%284%29%2C%20397%26%23x2013%3B402.%20%3Ca%20href%3D%27https%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1111%5C%2Fj.1399-6576.2009.02207.x%27%3Ehttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1111%5C%2Fj.1399-6576.2009.02207.x%3C%5C%2Fa%3E%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Premedication%20with%20clonidine%20is%20superior%20to%20benzodiazepines.%20A%20meta%20analysis%20of%20published%20studies%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22S%22%2C%22lastName%22%3A%22Dahmani%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22C%22%2C%22lastName%22%3A%22Brasher%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22I%22%2C%22lastName%22%3A%22Stany%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22J%22%2C%22lastName%22%3A%22Golmard%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22A%22%2C%22lastName%22%3A%22Skhiri%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22B%22%2C%22lastName%22%3A%22Bruneau%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Y%22%2C%22lastName%22%3A%22Nivoche%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22I%22%2C%22lastName%22%3A%22Constant%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22I%22%2C%22lastName%22%3A%22Murat%22%7D%5D%2C%22abstractNote%22%3A%22BACKGROUND%5Cn%5CnPremedication%20is%20considered%20important%20in%20pediatric%20anesthesia.%20Benzodiazepines%20are%20the%20most%20commonly%20used%20premedication%20agents.%20Clonidine%2C%20an%20alpha2%20adrenoceptor%20agonist%2C%20is%20gaining%20popularity%20among%20anesthesiologists.%20The%20goal%20of%20the%20present%20study%20was%20to%20perform%20a%20meta-analysis%20of%20studies%20comparing%20premedication%20with%20clonidine%20to%20Benzodiazepines.%5Cn%5Cn%5CnMETHODS%5Cn%5CnA%20comprehensive%20literature%20search%20was%20conducted%20to%20identify%20clinical%20trials%20focusing%20on%20the%20comparison%20of%20clonidine%20and%20Benzodiazepines%20for%20premedication%20in%20children.%20Six%20reviewers%20independently%20assessed%20each%20study%20to%20meet%20the%20inclusion%20criteria%20and%20extracted%20data.%20Original%20data%20from%20each%20trial%20were%20combined%20to%20calculate%20the%20pooled%20odds%20ratio%20%28OR%29%20or%20the%20mean%20differences%20%28MD%29%2C%2095%25%20confidence%20intervals%20%5B95%25%20CI%5D%20and%20statistical%20heterogeneity%20were%20accessed.%5Cn%5Cn%5CnRESULTS%5Cn%5CnTen%20publications%20fulfilling%20the%20inclusion%20criteria%20were%20found.%20Premedication%20with%20clonidine%2C%20in%20comparison%20with%20midazolam%2C%20exhibited%20a%20superior%20effect%20on%20sedation%20at%20induction%20%28OR%3D0.49%20%5B0.27%2C%200.89%5D%29%2C%20decreased%20the%20incidence%20of%20emergence%20agitation%20%28OR%3D0.25%20%5B0.11%2C%200.58%5D%29%20and%20produced%20a%20more%20effective%20early%20post-operative%20analgesia%20%28OR%3D0.33%20%5B0.21%2C%200.58%5D%29.%20Compared%20with%20diazepam%2C%20clonidine%20was%20superior%20in%20preventing%20post-operative%20nausea%20and%20vomiting%20%28PONV%29.%5Cn%5Cn%5CnDISCUSSION%5Cn%5CnPremedication%20with%20clonidine%20is%20superior%20to%20midazolam%20in%20producing%20sedation%2C%20decreasing%20post-operative%20pain%20and%20emergence%20agitation.%20However%2C%20the%20superiority%20of%20clonidine%20for%20PONV%20prevention%20remains%20unclear%20while%20other%20factors%20such%20as%20nausea%20prevention%20might%20interfere%20with%20this%20result.%22%2C%22date%22%3A%22Apr%202010%22%2C%22language%22%3A%22%22%2C%22DOI%22%3A%2210.1111%5C%2Fj.1399-6576.2009.02207.x%22%2C%22ISSN%22%3A%221399-6576%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22GAJTTVTX%22%5D%2C%22dateModified%22%3A%222013-01-14T13%3A36%3A46Z%22%7D%7D%2C%7B%22key%22%3A%22JF3K3EMN%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Blaudszun%20et%20al.%22%2C%22parsedDate%22%3A%222012-06%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%3EBlaudszun%2C%20G.%2C%20Lysakowski%2C%20C.%2C%20Elia%2C%20N.%2C%20%26amp%3B%20Tram%26%23xE8%3Br%2C%20M.%20R.%20%282012%29.%20Effect%20of%20perioperative%20systemic%20%26%23x3B1%3B2%20agonists%20on%20postoperative%20morphine%20consumption%20and%20pain%20intensity%3A%20systematic%20review%20and%20meta-analysis%20of%20randomized%20controlled%20trials.%20%3Ci%3EAnesthesiology%3C%5C%2Fi%3E%2C%20%3Ci%3E116%3C%5C%2Fi%3E%286%29%2C%201312%26%23x2013%3B1322.%20%3Ca%20href%3D%27https%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1097%5C%2FALN.0b013e31825681cb%27%3Ehttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1097%5C%2FALN.0b013e31825681cb%3C%5C%2Fa%3E%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Effect%20of%20perioperative%20systemic%20%5Cu03b12%20agonists%20on%20postoperative%20morphine%20consumption%20and%20pain%20intensity%3A%20systematic%20review%20and%20meta-analysis%20of%20randomized%20controlled%20trials%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Gr%5Cu00e9goire%22%2C%22lastName%22%3A%22Blaudszun%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Christopher%22%2C%22lastName%22%3A%22Lysakowski%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Nadia%22%2C%22lastName%22%3A%22Elia%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Martin%20R%22%2C%22lastName%22%3A%22Tram%5Cu00e8r%22%7D%5D%2C%22abstractNote%22%3A%22BACKGROUND%5Cn%5CnSystemic%20%5Cu03b12%20agonists%20are%20believed%20to%20reduce%20pain%20and%20opioid%20requirements%20after%20surgery%2C%20thus%20decreasing%20the%20incidence%20of%20opioid-related%20adverse%20effects%2C%20including%20hyperalgesia.%5Cn%5Cn%5CnMETHODS%5Cn%5CnThe%20authors%20searched%20for%20randomized%20placebo-controlled%20trials%20testing%20systemic%20%5Cu03b12%20agonists%20administrated%20in%20surgical%20patients%20and%20reporting%20on%20postoperative%20cumulative%20opioid%20consumption%20and%5C%2For%20pain%20intensity.%20Meta-analyses%20were%20performed%20when%20data%20from%205%20or%20more%20trials%20and%5C%2For%20100%20or%20more%20patients%20could%20be%20combined.%5Cn%5Cn%5CnRESULTS%5Cn%5CnThirty%20studies%20%281%2C792%20patients%2C%20933%20received%20clonidine%20or%20dexmedetomidine%29%20were%20included.%20There%20was%20evidence%20of%20postoperative%20morphine-sparing%20at%2024%20h%3B%20the%20weighted%20mean%20difference%20was%20-4.1%20mg%20%2895%25%20confidence%20interval%2C%20-6.0%20to%20-2.2%29%20with%20clonidine%20and%20-14.5%20mg%20%28-22.1%20to%20-6.8%29%20with%20dexmedetomidine.%20There%20was%20also%20evidence%20of%20a%20decrease%20in%20pain%20intensity%20at%2024%20h%3B%20the%20weighted%20mean%20difference%20was%20-0.7%20cm%20%28-1.2%20to%20-0.1%29%20on%20a%2010-cm%20visual%20analog%20scale%20with%20clonidine%20and%20-0.6%20cm%20%28-0.9%20to%20-0.2%29%20with%20dexmedetomidine.%20The%20incidence%20of%20early%20nausea%20was%20decreased%20with%20both%20%28number%20needed%20to%20treat%2C%20approximately%20nine%29.%20Clonidine%20increased%20the%20risk%20of%20intraoperative%20%28number%20needed%20to%20harm%2C%20approximately%20nine%29%20and%20postoperative%20hypotension%20%28number%20needed%20to%20harm%2C%2020%29.%20Dexmedetomidine%20increased%20the%20risk%20of%20postoperative%20bradycardia%20%28number%20needed%20to%20harm%2C%20three%29.%20Recovery%20times%20were%20not%20prolonged.%20No%20trial%20reported%20on%20chronic%20pain%20or%20hyperalgesia.%5Cn%5Cn%5CnCONCLUSIONS%5Cn%5CnPerioperative%20systemic%20%5Cu03b12%20agonists%20decrease%20postoperative%20opioid%20consumption%2C%20pain%20intensity%2C%20and%20nausea.%20Recovery%20times%20are%20not%20prolonged.%20Common%20adverse%20effects%20are%20bradycardia%20and%20arterial%20hypotension.%20The%20impact%20of%20%5Cu03b12%20agonists%20on%20chronic%20pain%20or%20hyperalgesia%20remains%20unclear%20because%20valid%20data%20are%20lacking.%22%2C%22date%22%3A%22Jun%202012%22%2C%22language%22%3A%22%22%2C%22DOI%22%3A%2210.1097%5C%2FALN.0b013e31825681cb%22%2C%22ISSN%22%3A%221528-1175%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22REGTAX4T%22%5D%2C%22dateModified%22%3A%222013-01-14T13%3A36%3A00Z%22%7D%7D%2C%7B%22key%22%3A%22ZGZKIVZE%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Andrieu%20et%20al.%22%2C%22parsedDate%22%3A%222009-06%22%2C%22numChildren%22%3A0%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%3EAndrieu%2C%20G.%2C%20Roth%2C%20B.%2C%20Ousmane%2C%20L.%2C%20Castaner%2C%20M.%2C%20Petillot%2C%20P.%2C%20Vallet%2C%20B.%2C%20Villers%2C%20A.%2C%20%26amp%3B%20Lebuffe%2C%20G.%20%282009%29.%20The%20efficacy%20of%20intrathecal%20morphine%20with%20or%20without%20clonidine%20for%20postoperative%20analgesia%20after%20radical%20prostatectomy.%20%3Ci%3EAnesthesia%20and%20Analgesia%3C%5C%2Fi%3E%2C%20%3Ci%3E108%3C%5C%2Fi%3E%286%29%2C%201954%26%23x2013%3B1957.%20%3Ca%20href%3D%27https%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1213%5C%2Fane.0b013e3181a30182%27%3Ehttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1213%5C%2Fane.0b013e3181a30182%3C%5C%2Fa%3E%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22The%20efficacy%20of%20intrathecal%20morphine%20with%20or%20without%20clonidine%20for%20postoperative%20analgesia%20after%20radical%20prostatectomy%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Gr%5Cu00e9goire%22%2C%22lastName%22%3A%22Andrieu%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Benjamin%22%2C%22lastName%22%3A%22Roth%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Laoual%22%2C%22lastName%22%3A%22Ousmane%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Michel%22%2C%22lastName%22%3A%22Castaner%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Patrice%22%2C%22lastName%22%3A%22Petillot%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Benoit%22%2C%22lastName%22%3A%22Vallet%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Arnauld%22%2C%22lastName%22%3A%22Villers%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Gilles%22%2C%22lastName%22%3A%22Lebuffe%22%7D%5D%2C%22abstractNote%22%3A%22BACKGROUND%5Cn%5CnIn%20this%20randomized%20study%2C%20we%20compared%20intrathecal%20%28i.t.%29%20morphine%20with%20or%20without%20clonidine%20and%20i.v.%20postoperative%20patient-controlled%20analgesia%20%28PCA%29%20morphine%20for%20analgesia%20after%20radical%20retropubic%20prostatectomy.%5Cn%5Cn%5CnMETHODS%5Cn%5CnFifty%20patients%20were%20randomly%20divided%20into%20three%20groups.%20They%20were%20allocated%20to%20receive%20i.t.%20morphine%20%284%20microg%5C%2Fkg%29%20%28M%20group%29%2C%20i.t.%20morphine%20and%20clonidine%20%281%20microg%5C%2Fkg%29%20%28MC%20group%29%2C%20or%20PCA%20%28PCA%20group%29.%20Each%20patient%20was%20given%20morphine%20PCA%20for%20postoperative%20analgesia.%20The%20primary%20objective%20was%20the%20quantity%20of%20morphine%20required%20during%20the%20first%2048%20postoperative%20hours.%20The%20first%20request%20for%20morphine%2C%20numeric%20pain%20score%20at%20rest%20and%20on%20coughing%2C%20the%20time%20of%20tracheal%20decannulation%20and%20adverse%20effects%20%28pruritus%2C%20postoperative%20nausea%20and%20vomiting%2C%20respiratory%20depression%29%20were%20recorded.%5Cn%5Cn%5CnRESULTS%5Cn%5CnMorphine%20consumption%20in%20the%20first%2048%20h%20was%20decreased%20in%20the%20M%20and%20MC%20groups.%20The%20numeric%20pain%20score%20at%20rest%20and%20on%20coughing%20were%20lower%20in%20the%20M%20group%20until%20the%2018th%20postoperative%20hour%20and%20until%20the%2024th%20postoperative%20hour%20in%20the%20MC%20group.%20The%20first%20requests%20for%20PCA%20were%20delayed%20in%20these%20two%20groups.%20The%20need%20for%20intraoperative%20sufentanil%20was%20significantly%20lower%20in%20the%20MC%20group.%5Cn%5Cn%5CnCONCLUSION%5Cn%5CnIT%20morphine%20provided%20a%20significant%20reduction%20in%20morphine%20requirement%20during%20the%20first%2048%20postoperative%20hours%20after%20a%20radical%20prostatectomy.%20The%20addition%20of%20clonidine%20to%20i.t.%20morphine%20reduced%20intraoperative%20sufentanil%20use%2C%20prolonged%20time%20until%20first%20request%20for%20PCA%20rescue%2C%20and%20further%20prolonged%20analgesia%20at%20rest%20and%20with%20coughing.%22%2C%22date%22%3A%22Jun%202009%22%2C%22language%22%3A%22%22%2C%22DOI%22%3A%2210.1213%5C%2Fane.0b013e3181a30182%22%2C%22ISSN%22%3A%221526-7598%22%2C%22url%22%3A%22http%3A%5C%2F%5C%2Fwww.ncbi.nlm.nih.gov%5C%2Fpubmed%5C%2F19448230%22%2C%22collections%22%3A%5B%222WRS5ZHU%22%2C%2233MVZNNS%22%5D%2C%22dateModified%22%3A%222012-10-29T21%3A24%3A36Z%22%7D%7D%5D%7D
Chan, A. K. M., Cheung, C. W., & Chong, Y. K. (2010). Alpha-2 agonists in acute pain management.
Expert Opinion on Pharmacotherapy,
11(17), 2849–2868.
https://doi.org/10.1517/14656566.2010.511613
Oddby-Muhrbeck, E., Eksborg, S., Bergendahl, H. T. G., Muhrbeck, O., & Lönnqvist, P. A. (2002). Effects of clonidine on postoperative nausea and vomiting in breast cancer surgery. Anesthesiology, 96(5), 1109–1114.
Taheri, A., Javadimanesh, M. A., & Ashraf, H. (2010). The effect of oral clonidine premedication on nausea and vomiting after ear surgery. Middle East Journal of Anesthesiology, 20(5), 691–694.
Hamaya, Y., Nishikawa, T., & Dohi, S. (1994). Diuretic effect of clonidine during isoflurane, nitrous oxide, and oxygen anesthesia. Anesthesiology, 81(4), 811–819.
Mertes, N., Goeters, C., Kuhmann, M., & Zander, J. F. (1996). Postoperative alpha 2-adrenergic stimulation attenuates protein catabolism. Anesthesia and Analgesia, 82(2), 258–263.
Pichot, C., Longrois, D., Ghignone, M., & Quintin, L. (2012). Dexmédétomidine et clonidine : revue de leurs propriétés pharmacodynamiques en vue de définir la place des agonistes alpha-2 adrénergiques dans la sédation en réanimation.
Annales Françaises d’Anesthésie et de Réanimation,
31(11), 876–896.
https://doi.org/10.1016/j.annfar.2012.07.018
De Kock, M., Wiederkher, P., Laghmiche, A., & Scholtes, J. L. (1997). Epidural clonidine used as the sole analgesic agent during and after abdominal surgery. A dose-response study.
Anesthesiology,
86(2), 285–292.
http://www.ncbi.nlm.nih.gov/pubmed/9054246
Stühmeier, K. D., Mainzer, B., Cierpka, J., Sandmann, W., & Tarnow, J. (1996). Small, oral dose of clonidine reduces the incidence of intraoperative myocardial ischemia in patients having vascular surgery. Anesthesiology, 85(4), 706–712.
Scheinin, H., Aantaa, R., Anttila, M., Hakola, P., Helminen, A., & Karhuvaara, S. (1998). Reversal of the sedative and sympatholytic effects of dexmedetomidine with a specific alpha2-adrenoceptor antagonist atipamezole: a pharmacodynamic and kinetic study in healthy volunteers. Anesthesiology, 89(3), 574–584.
Talke, P. (1998). Receptor-specific reversible sedation: beginning of new era of anesthesia? Anesthesiology, 89(3), 560–561.
Park, S. M., Mangat, H. S., Berger, K., & Rosengart, A. J. (2012). Efficacy spectrum of antishivering medications.
Critical Care Medicine,
40(11), 3070–3082.
https://doi.org/10.1097/CCM.0b013e31825b931e
Pöpping, D. M., Elia, N., Marret, E., Wenk, M., & Tramèr, M. R. (2009). Clonidine as an adjuvant to local anesthetics for peripheral nerve and plexus blocks: a meta-analysis of randomized trials.
Anesthesiology,
111(2), 406–415.
https://doi.org/10.1097/ALN.0b013e3181aae897
Dahmani, S., Brasher, C., Stany, I., Golmard, J., Skhiri, A., Bruneau, B., Nivoche, Y., Constant, I., & Murat, I. (2010). Premedication with clonidine is superior to benzodiazepines. A meta analysis of published studies.
Acta Anaesthesiologica Scandinavica,
54(4), 397–402.
https://doi.org/10.1111/j.1399-6576.2009.02207.x
Blaudszun, G., Lysakowski, C., Elia, N., & Tramèr, M. R. (2012). Effect of perioperative systemic α2 agonists on postoperative morphine consumption and pain intensity: systematic review and meta-analysis of randomized controlled trials.
Anesthesiology,
116(6), 1312–1322.
https://doi.org/10.1097/ALN.0b013e31825681cb
Andrieu, G., Roth, B., Ousmane, L., Castaner, M., Petillot, P., Vallet, B., Villers, A., & Lebuffe, G. (2009). The efficacy of intrathecal morphine with or without clonidine for postoperative analgesia after radical prostatectomy.
Anesthesia and Analgesia,
108(6), 1954–1957.
https://doi.org/10.1213/ane.0b013e3181a30182


24 réponses sur « La clonidine »
la clonidine était un un des produits majeurs de la pharmacopée hypotensive des années 70 , a disparu totalement après l’arrivée des nouvelles classes, au delà de la somnolence parfois son effet secondaire majeur était la survenue possible de crises hypertensives majeures lors des interruptions intempestives dès le deuxième jour:quid en utilisation aigue?
Bonjour,
en aigü ça peut donner un peu de somnolence mais je dirais :
1) faire attention aux boli, l’administration en SAP est plus douce pour le patient
2) bien aussi en périopératoire car participe à l’analgésie (HTA sur douleur ?)
3) bien aussi pour contrôler le côté « patient énervé, agité » un peu neurotonique qui monte sa PA
4) je n’observe donc pas de rebond hypertensif à titre personnel dans ce contexte
5) la somnolence diminue au fil de la prise chronique, une sorte de mithridatisation ou plus simplement dit de tolérance 😉
à bientôt
rien a redire, a rajouter : épargne morphinique ( pca ) possible, diminution des effets secondaires de cette derniere ( documenté depuis longtemps mais tombé un peu dans l’oubli comme dit plus haut ), synergie avec la ketamine en subanésthésique, avec l’intéréssante propriété d’antagoniser les effets psychotropes délétères de cette dernière ( pratique pour nos jeunes neurotoniques qui n’en demandent pas tant ) ( je n’ai plus la documentation la dessus mais c’est avéré ). Comme dit plus haut une molécule dont l’indication principale fait qu’elle est malheureusement tombé dans l’oubli mais possède un potentiel dans ses propriétés qui ferait bon de la voir revenir.
Cordialement
Ah le catapressan. Étant né dedans, disciple de Marc De Kock, je connais un peu … Je voudrais juste ajouter : il est plus sédatif chez l’homme jeune que la femme âgée … L’hypotension qu’il induit est lié à son effet imidazoline (comme l’hyperium, ce piètre antiHTA). D’ailleurs, la dexmedetomidine qui n’est pas une imidazoline n’est que peu hypotensive. Idem pour le mivazerol, un autre alpha2 agoniste qui n’est jamais arrivé sur le marché.
En péri, il est le roi des analgésiques ! Aux USA, l’utilisation parentérale de la clonidine est uniquement permise par cette voie, confirmation sa place incontournable dans le traitement de la douleur.
Méfiance cependant … la bradycardie et l’hypotension qu’on voit après les doses élevées de clonidine correspondent à une baisse drastique du débit cardiaque …. Souhaitable dans certains cas mais parfois dangereuse.
Je pense aussi (comme beaucoup d’autres) qu’il peut (? doit) être utilisé sans crainte et à des larges doses chez les alcooliques. Ils ne souffriront pas de cette sédation ni d’effets hémodynamiques marqués. De plus la clonidine prévient et traite efficacement le DT.
Je reste prudent avec cette molécule … Marc De Kock l’a utilisé à des doses folles sans que je n’aie vraiment compris le bénéfice, hormis une épargne d’opioïdes et au prix d’une sédation profonde prolongée, une pâleur cadavérique et un rebond hypertensif et hypervigile au sevrage.
Bonjour,
Question bête de l’OPH de base. On sait que les béta-bloquants collyres peuvent avoir des effets systémiques parfois loin d’être négligeables. Beaucoup plus rarement il nous arrive de prescrire de l’apraclonidine : Iopidine 1% ponctuellement, 0.5% un peu plus longtemps voire parfois assez longtemps dans certains glaucomes chroniques.
Ca peut avoir une importance ?
Classiquement 1 goutte = 1/20ème de ml
1% = 10 mg/ml
Mais peut être que sur la notice du produit il est écrit plus clairement la quantité de clonidine dans une goutte, tu pourras me dire un de ces 4 ?
1 goutte = 500 µg c’est pas mal quand même ! Mais quid du retentissement général… Constates-tu un retentissement général comme une petite sédation, une baisse de pression artérielle ?
Je mets régulièrement des doses comme 600 µg/jour en SAP en IV, les patients ne sont pas comateux mais c’est vrai que l’on peut avoir une méfiance de principe si tu as déjà des patients bradycardes, âgés avec BAV ou fortes doses de traitements chronotropes négatifs -> leur conseiller d’être prudent au lever ?
bye !
Bon, je prends une unidose Iopidine 1% : elle est annoncée pour 0.25 ml. Je la vide, contrôle avec sa copine de blister: 3 belles goutte et une petite chacune,. Mettons 3.5 goutte par dose soit 0.07 ml par dose. Ensuite, je lis: 2.875 mg de chlorhydrate d’apraclonidine pour un récipient unidose, correspondant à 2.500 mg d’apraclonidine base. Soit environ 0.82 mg de chlorhydrate par goutte et 0.71 mg de base.
Même à la louche c’est plus que tes estimations. Cela dit, une goutte instillée n’est pas une goutte absorbée, il y a un gros débordement. Il faut que je me renseigne sur le volume du film lacrymal…
Erratum : 1 goutte de Iopidine 1% = 0.07 ml environ.
[…] Ainsi je préfère clairement d’autres molécules pour prendre en charge les patients confus et/ou agités. Une fois que les causes médicales classiques ont été recherchées et écartées, je prescris volontiers des benzodiazépines en première intention : oxazepam quand la voie per os est utilisable, sinon je craque pour du midazolam voire du diazepam en IV. Je n’ai pas peur de la dépression respiratoire car aux posologies thérapeutiques je ne pense pas que ce risque soit important et quand bien même ce choix aurait été mauvais on dispose d’un antidote très efficace. Donc oui aux benzos pour les agitations aigües ! En deuxième ligne, si le patient est correctement hydraté et qu’il semble souffrir d’un syndrome confusionnel grave, je n’hésite pas à utiliser des neuroleptiques à petites doses : halopéridol en première intention et cyamémazine en deuxième ligne. J’associe aussi volontiers de la clonidine. […]
Question de patiente. Question qui vaut ce qu’elle vaut.
Question qui m’est passée par la tête en lisant votre billet.
Avez-vous déjà entendu parler de la clonidine dans le traitement du TDAH (souvent associé au TOP, Trouble d’Opposition avec Provocation) ? Traitement approuvé par la FDA aux États-Unis et par les autorités de santé dans la plupart des pays anglophones (et non, je n’invente rien du tout).
Avez-vous entendu parler d’anesthésistes qui remplacent les stimulants (pour le TDAH) par de la clonidine dans le cadre d’une opération ?
Je vous demande ça parce votre article montre que vous avez une expérience d’utilisation de la clonidine. Je me suis donc dit que poser ce genre de question générale ne mange pas forcément de pain. En prime, j’irai me coucher moins bête 😉
Sachant que l’agitation du patient atteint de TDAH n’est pas forcément due à un quelconque statut d’ « addictif sévère » comme vous le dites si bien.
J’ai bien un problème de TDAH, j’ai bien des dommages cérébraux qui se voient sur l’IRM comme mon nez au milieu de la figure (dixit le radiologue) et corrélés au TDAH (dixit le neurologue), mais je n’ai jamais eu de problèmes avec les addictions (du moins, jusqu’à l’heure actuelle). J’ai amplement ce qu’il me faut en matière de suivi pour détecter les problèmes d’addictions si ceci se présentaient, FYI.
Vous me ferez le plus beau des cadeaux le jour où vous comme vos confrères des spécialités somatiques divorceront la maladie neuropsy d’une obligation de conduite addictive. Le jour où ça arrivera, ce sera comme le matin de Noël en train d’ouvrir mes cadeaux.
Bonjour,
je sais que la clonidine est utilisée dans le TDAH pour l’avoir vu pendant mes recherches mais comme je ne m’occupe pas spécialement de patients avec TDAH je n’ai pas creusé la question.
Pour moi l’utilisation de la clonidine est logique dans ce contexte mais comme nous en avons déjà discuté il y a plusieurs façons de conduire une anesthésie et les différentes façons ne montrent pas forcément de différences au bout du compte.
Quant à la confusion addiction/agitation je ne suis pas certains d’avoir compris vos propos ou vos sous-entendus. Toujours est-il que la problématique du sevrage à l’hopital, au décours d’une opération qui nécessite une longue hospitalisation, est un vrai problème. La aussi la clonidine peut rendre des services.
Concernant l’affaire de l’ « addictif sévère », je veux en venir que la plupart des médecins dans les spécialités somatiques considèrent que « maladie psy ou neuropsy » est nécessairement associé à un problème d’addiction.
Le problème, c’est que la maladie psy/neuropsy n’est pas forcément associé à l’addiction.
Je trouve que la façon dont vous avez mis « l’addict sévère » sur le tapis est une vision très réductrice de la maladie psy/neuropsy.
J’aurais apprécié que votre idée soit exprimée en étant moins réductrice.
Après, j’entends tout à fait que le problème de sevrage dans le cas d’une hospitalisation est un problème pour les soignants. Ça, ok, c’est une difficulté qui s’entend.
Dans ce cas, j’aurais apprécié que vous donniez des explications plus claires et plus développées sur cette difficulté de sevrage.
D’ailleurs, je crois que le sujet du sevrage avant anesthésie mériterait un billet de blog à lui tout seul. Ou, du moins, une partie de ce billet qui développe la problématique.
Ça aurait été plus clair, plus pertinent et aurait été un sujet vraiment intéressant à développer.
Bonjour,
pardon mais je pense que vous lisez ce que vous avez envie de lire. Il n’y a aucune arrière pensée particulière dans mes propos.
Les coronariens devrait se vexer aussi ??!
Vous pouvez vivre des choses que je ne connais pas, sans je n’en doute pas mais mon billet traite de ma vision de la clonidine dans ma pratique d’anesthesiste-réanimateur, voilà, ni plus ni moins.
Quant à ce blog, c’est mon espace de liberté, j’en fais ce que je veux. En tout cas je n’irai pas plus loin dans cette conversation vue la tournure des propos.
Bonne soirée !
C’est vous qui le dites.
Oula! Je parie un billet de 50 qu’elle bosse soit dans le médical, soit dans l’éducation…
Et qu’elle a choisit une mutuelle qui rembourse à 100% tout ce qui est homéopathie…
Sinon super site, merci pour tout le boulot et de partager comme ça c’est top
[…] risque de chronicisation de sa douleur post-opératoire et/ou de NVPO, j’utilise souvent la clonidine. Je l’administre dans la perfusion de départ à une posologie oscillant entre 1 et 4 µg/kg. […]
Alors tout d’abord, magnifique blog, je le consulte régulièrement et j’y ai appris des tas de choses. En ce moment, je découvre l’anesthésie façon belge, avec le protocole xylo/kéta/catapressan. J’avais 2 questions:
-Pour cette dernière molécule, quelle est votre protocole quand vous l’associez à la xylo/kéta en IV et dans la péri ? Je reconnais que je tatonne un peu, IVPSE de 1 à 2 gamma/kg/h, je module la vitesse en fonction des effets hémodynamiques. En péridurale, je ne l’utilise qu’en bolus en début d’intervention. Vous l’utilisez comment en péridurale ?
-Désormais, une molécule apparentée au catapressan est disponible, le DEXDOR. Compte-tenu de ses propriétés similaires à la clonidine (sédatifs, analgésiques, anxiolytiques) et une demi-vie plus courte, est-ce qu’on pourrait l’utiliser au bloc avec le protocole xylo/kéta à la place de la clonidine ? Est-ce que vous avez des informations à propos du DEXDOR en anesthésie ?
D’avance, merci pour les informations et encore merci pour ce blog !
Merci pour vos sympathiques remarques.
Pour la clonidine en IVSE je fais exactement comme vous dites. Souvent au bout de 1 gamma/kg on voit que le patient est imprégné.
En péridurale je le fais peu, l’article de De Kock sur le sujet vous éclairera mieux que moi.
La dex est utilisée de longue date aux US. Nous ne l’utilisons pas dans notre hopital car elle est beaucoup plus chère que la clonidine sans avantage marqué à mon sens.
Bonne journée
peut on associer la clonidine (et a quelle dose) a la morphine en intra thecal dans le cadre du traitement de dlrs chroniques neurogens liées a une méningite carcinomateuse de cancer du sein..?
pour ma part j’avoue ne pas trop oser faire les doses DeKockienne (cf biblio) de clonidine en intrathécale mais oui je pense que c’est tout à fait possible.
Après, je trouve ça moins maniable qu’en SAP, donc je conserve ma stratégie décrite dans le billet.
Pour quelles chirurgies seriez vous intéressé ?
pour l’utilisation de la clonidine en anesthesie, il y a un must read en français de JM Bernard et al ds les AFAR au debut des années 90. taper Bernard JM sur Pub Med ça sortira.
Ok merci
Bonjour,
Marc, Patient.
Souffrant d’une irritation du sympathique droit par un foramen arcualé sur l’arc postérieur de C1, sous TARKA 240 LP 1/0/1 pour hypertension labile et poussées hypertensives et pulsatiles, sous LYRICA 1800 mg/j pour douleur neuropathiques. Pensez vous que la CLONIDINE est les capacités à réduire l’excitabilité neuronale ou le tonus sympathique induit par cette irritation.
En vous remerciant d’avance pour vos réponses car la souffrance rend impatient.
Cordialement.
Marc
Bonjour Monsieur,
la médecine par Internet n’est pas souhaitable.
J’espère que vous avez un bon relationnel avec les médecins du centre anti douleur de votre région.
Concernant la clonidine, je pense que c’est plus adapté à des phénomènes aigus comme le périoperatoire. En effet la clonidine souffre souvent de tachyphylaxie et d’un effet rebond à l’arrêt lors d’une prise au long cours.
Je vous souhaite que tout se passe bien pour vous.