L’un de mes principes forts c’est de savoir pourquoi on donne un traitement à un patient. (L’autre dada c’est de travailler à bien donner le traitement.) Ainsi je travaille depuis un moment à limiter l’oxygénothérapie inutile.
Aujourd’hui, je passe le clavier à Minh, qui avec son style et des nouvelles publications que je ne connaissais pas (recos BTS) renforce le message. Je lui passe le clavier.
Bonjour,
Je me présente, Minh Nguyen, anesthésiste-réanimateur exerçant à Lille (ou plus précisément à Seclin).
Je remercie Rémi de me proposer son blog pour m’exprimer. Je trouve ce support très efficace pour faire changer les pratiques, comme l’a montré un ancien billet estival sur la noradrénaline diluée. Avec une mise à jour des pratiques de Rémi/nfkb là.
Je commence par la conclusion : l’oxygène (ou plutôt di-oxygène) O2, comporte deux O : le O du yin et le O du yang : l’oxygène, c’est bénéfique, mais l’oxygène, c’est aussi maléfique. En témoigne sa vraie formule chimique :
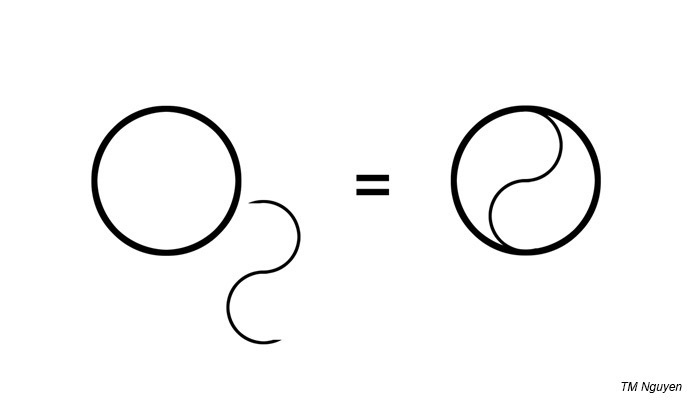
Nous introduisons le sujet par 3 citations que mes oreilles ont dérobées au quotidien :
L’oxygène (ou dioxygène) O2 est le dernier accepteur d’électrons dans la chaine respiratoire mitochondriale, permettant l’afflux de protons dans l’espace intermembranaire. Ces protons, concentrés dans l’espace intermembranaire, n’auront de porte de sortie autre que le canal de l’ATP synthase. Le bain de foule protonique sortant fait tourner les tourniquets, force motrice nécessaire à l’assemblage d’ADP et de P. Et paf, ça fait de l’ATP / Donc de la vie / Pas d’ATP = pas de vie / Pas d’O2 = pas d’ATP = pas de vie. (En réalité pas totalement vrai pour les puristes, mais ce billet se veut simple et pratique.) Donc l’oxygène, c’est bien.
Il arrive parfois que l’oxygène choppe un électron libre, puis par une série de réactions, se transforme en « espèces réactives de l’oxygène » (ERO). Ce sont des radicaux libres, des ions oxygénés ou des peroxydes ; les plus connus étant l’anion superoxyde, le peroxyde de dihydrogène, le radical hydroxyle. Ils sont responsables d’agression des constituants de la cellule, l’ADN, les protéines, les membranes, … un peu tout en fait. Cette agression s’appelle le stress oxydant. Ce stress oxydant est agressif. Donc l’oxygène, c’est bien, mais ça donne des espèces réactives de l’oxygène, et ça, c’est moins bien.
Notre organisme, soumis continuellement à ce stress oxydant, se défend grâce à un système antioxydant. Il s’agit d’enzymes type superoxyde dismutase, manganèse superoxyde dismutase, des catalases, des catalases mitochondriales, des peroxydases, d’autres molécules comme la vitamine C, la vitamine E, le glutathion, l’albumine… Grâce à ce système antioxydant, notre organisme limite les dégâts du stress oxydant. Donc l’oxygène, c’est bien, mais ça donne des espèces réactives de l’oxygène, et ça, c’est moins bien, mais on les neutralise avec notre système antioxydant, donc ça va, l’oxygène au final, c’est bien.
Certaines espèces n’ont pas la machinerie antioxydante pour se défendre contre les ERO, c’est le cas par exemple des bactéries. En 2016, l’Organisation Mondiale de la Santé (OMS) publie un guide des recommandations pour diminuer l’incidence des infections du site opératoire (1) : ça parle de beaucoup de points, par exemple du rasage (délétère), du lavage des mains (eau+savon ne sert à rien (sauf si peau souillée), solution hydroalcoolique suffit), de l’antibioprophylaxie, … et aussi de l’oxygénation péri-opératoire : « Le panel recommande que les patients adultes bénéficiant d’interventions chirurgicales sous anesthésie générale avec intubation endotrachéale devraient recevoir une FiO2 à 80% en peropératoire et, si possible, en postopératoire immédiat pendant 2 à 6 heures pour réduire le risque d’infection du site opératoire. » (Recommandation forte, niveau de preuve modéré). Gros pavé dans la marre. Le monde des ‘gens qui s’intéressent à l’oxygène’ s’excite, et s’ensuit une série de publications, d’édito et de travaux sur la FiO2 à administrer. En 2019, dans le prestigieux journal British Journal of Anesthesiology (BJA) est publiée la dernière méta-analyse incluant 21 essais randomisés contrôlés dont 6 nouveaux depuis la publication des recommandations de l’OMS en 2016, retrouvant un bénéfice à administrer une FiO2 à 80% (vs 30%) chez les patients intubés, sur le taux d’infections du site opératoire (2).
En voilà, un réel bénéfice de l’hyperoxémie. Mais en parallèle, y aurait-il un maléfice ?
Déjà, en 2015, la British Thoracic Society (BTS) avait publié un document intitulé “BTS Guideline for oxygen use in healthcare and emergency settings”, un gros pavé de recommandations sur l’administration d’oxygène dans presque toutes les situations (3). Y était introduit la notion de seuil haut de SpO2 à ne pas dépasser. De manière générale, il était recommandé d’avoir un objectif de SpO2 entre [94-98]%.
En 2017, le BJA publie une étude rétrospective incluant 74 000 patients bénéficiant d’une anesthésie, comparant l’effet d’une FiO2 à 30% versus une FiO2 à 80% sur les complications respiratoires. La FiO2 haute était corrélée à une incidence plus importante de complications respiratoires, et aussi à une mortalité à J30 plus importante (4).
Concernant les patients de réanimation, la 1ère étude randomisée est publiée en 2016 dans le JAMA, retrouvant une surmortalité lors d’une administration libérale d’oxygène (versus restrictive) (5). Je m’y intéressais car à l’époque je prenais des gardes de réanimation dans un centre (Saint Philibert) qui participait à une autre étude randomisée : publiée dans le Lancet en 2017, les résultats étaient similaires : surmortalité dans le groupe hyperoxémie (6). En 2018, une méta-analyse publiée dans le Lancet analysant 25 essais randomisés et 16 000 patients en soins intensifs retrouvait… une surmortalité corrélée à une SpO2 haute (7). Les auteurs concluaient : « Chez des patients en soins critiques, un haut niveau de preuve montre qu’une oxygénothérapie libérale augmente la mortalité sans améliorer les autres outcomes. L’oxygène additionnel peut devenir défavorable au-dessus d’une SpO2 de 94-96%. Ces résultats appuient la stratégie conservatrice de l’oxygénothérapie. »
Notre organisme, soumis continuellementaustress oxydant, se défend grâce à un système antioxydant.En temps normal, nous avons assez de défenses antioxydantes contre l’agression oxydante. Il y a des cas où nous n’avons pas assez de défenses antioxydantes par rapport à l’agression oxydante :
- quand le système antioxydant est immature : le cas du bébé (augmentation des complications neurologiques, de la mortalité lors d’une réanimation hyperoxémique) (8)
- quand le système antioxydant est consommé : le cas d’une réaction inflammatoire mobilisant notre système antioxydant, par exemple le sepsis, les brûlures, l’hémorragie sous-arachnoidienne, ..
- quand le système antioxydant ne peut pas agir : le cas de l’hypoxémie : en effet, pas d’O2, pas d’ATP… et pas d’ATP, pas de réaction enzymatique d’antioxydation (9)
- quand on apporte une agression oxydante additionnelle : apport de « trop » d’oxygène, donc d’espèces réactives de l’oxygène (3-8)
- et généralement, c’est plutôt un mix de toutes ces situations. Exemple typique : infarctus du myocarde : occlusion coronaire : il n’y a plus d’O2 qui arrive au tissu myocardique.. « AAAH » fait le tissu. Il n’y a plus d’O2, donc plus d’ATP… Et le peu d’ATP qui est produit est utilisé pour le métabolisme basal de la cellule, pas pour des réactions enzymatiques de défense. C’est une crise énergétique. La souffrance tissulaire provoque une réaction inflammatoire, consommant le système antioxydant local. Ca va mal. Et nous, on veut bien faire, alorson met de l’O2, donc des ERO, qui viennent profiter d’une défense antioxydante locale affaiblie. L’agression oxydante, le stress oxydant, se fait grandissant… (Le stress est bientôt à son comble…). Vous le voyez venir ? … Qui ça ? Le cardi… REPERFUSION. D’un geste technique précis, le cardiologue vient de reperfuser la coronaire. Afflux massif d’O2 dans le tissu, dont une partie se transforme en ERO. A cet instant précis, il y a beaucoup trop d’ERO, le système antioxydant local est quantitativement insuffisant, et la machinerie énergétique n’a pas eu le temps de se remettre en route pouralimenter ses enzymes de défense. Tous les astres sont alignés.Nous sommes au centre commercial le 1er jour des soldes, à l’ouverture des grilles, dans le rayon high-tech-audio-informatique. C’est l’ischémie-reperfusion.
Revenons à plus simple : à la mise en pratique.
En 2018, le British Medical Journal (BMJ), publie des recommandations, les plus simples du monde (10) : « Rapid recommendations » = recommandations rapides, et en haut « Intended for healthcare professionals » = à l’intention des professionnels de santé.
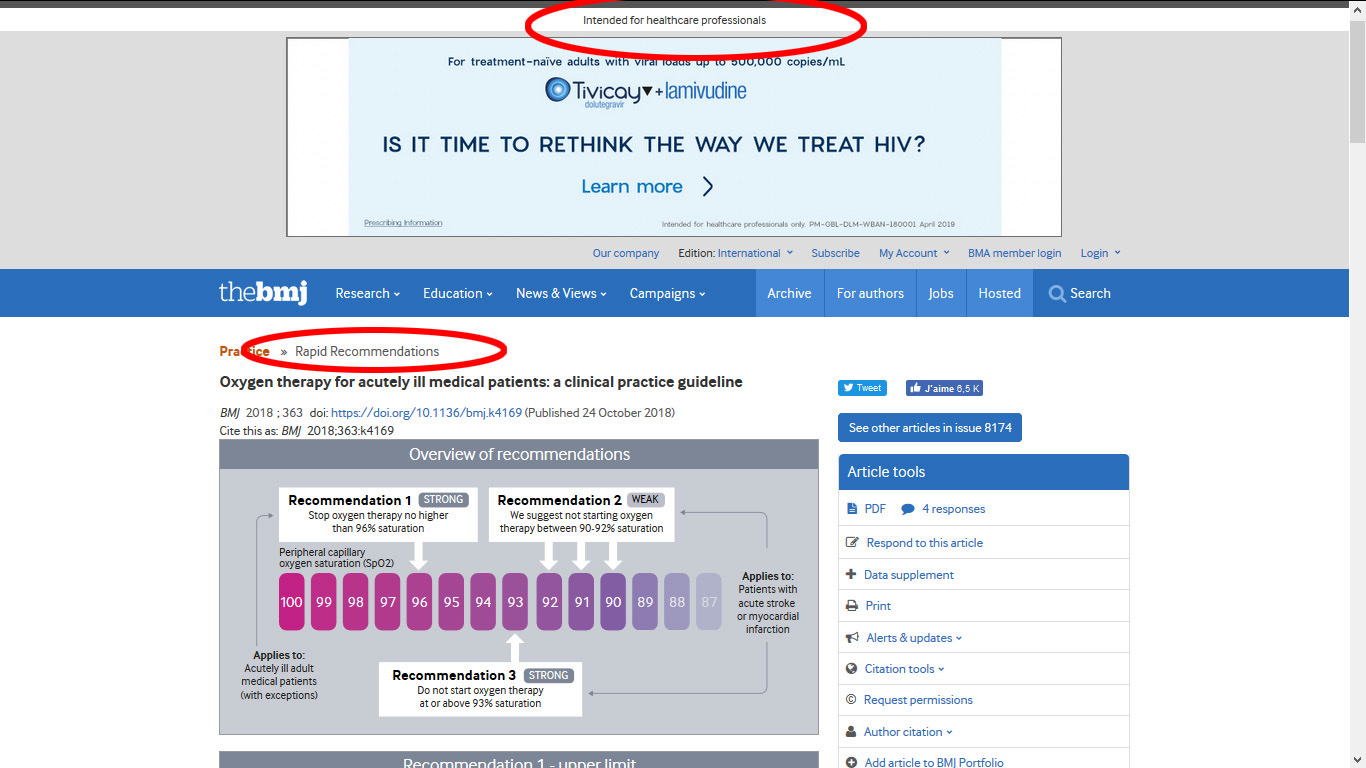

Ces recommandations tiennent en 3 points :
Facile, non ? Elles sont très simples, c’est très clair, et le rationnel de ces reco est accessible en cliquant sur « More details » sur les petites images. Ca prend 4 minutes à lire, et elles sont accessibles sur https://www.bmj.com/content/363/bmj.k4169
Donc au total :
- éviter l’hypoxémie (seuil bas de SpO2 non encore déterminé)
- en peropératoire : FiO2 haute est associée à moins de complications infectieuses mais à plus de complications respiratoires et une mortalité à J30 plus élevée (donc pas bien)
- en réanimation, soins intensifs, pathologies aigues : éviter l’hyperoxémie, et les seuils hauts (de SpO2) peuvent nous paraître assez bas : de manière générale sûrement 94-96%(voire 98% grand grand max), pour l’accident vasculaire cérébral et l’ischémie myocardique : probablement 90-92%, sûrement 93%
- il y a des exceptions : situations à risque de désaturation (péri-intubation, péri-extubation, pneumothorax avant drainage, …), crise drépanocytaire, intoxication au CO, embolie gazeuse, arrêt cardiaque avant récupération d’un rythme cardiaque spontané, …
- attention ce billet n’est pas une promotion de l’hypoxémie, mais une alerte à l’hyperoxémie.
Il faut donc changer son point de vue.
Tout est une question de point de vue. D’ailleurs, vous pouvez faire l’exercice : reprenez la 1ère image de ce billet : en regardant l’O2 d’un autre point de vue, vous y verrez… le ☯
Merci de m’avoir lu.
https://twitter.com/fluidloading/status/1163716437267099650?s=21
Pour aller un peu plus loin
Petit rappel sur le transport en O2 (TaO2) : il dépend du contenu en O2 (CaO2) et du débit cardiaque (Q). Le contenu artériel en O2 dépend de la part liée à l’hémoglobine (donc de l’hémoglobine (Hb) et de la saturation artérielle en O2 (SaO2)) et de la part dissous (PaO2 x 0,003 = négligeable). TaO2 = [Hb x SaO2 x k] x Q. Donc si le patient est hypotendu(petit Q), mais a une SpO2 suffisante, apporter de l’O2 n’augmentera pas mathématiquement son transport en O2. Il vaudrait mieux lui mettre un petit coup de pied au Q.
Recommandations pour FiO2 haute peropératoire :
Les pour :
- OMS 2016 (https://www.who.int/gpsc/ssi-guidelines/en/?fbclid=IwAR3ihmPmr9gd_7q5a9ihtJRRLz3MpGuGYecZASNJS_rMV4ok_6IMToznpFk)
- American College of Surgeons and Surgical Infection Society 2016 (https://www.journalacs.org/article/S1072-7515(16)31563-0/fulltext?fbclid=IwAR33msuqorQVIWEZA0Jizbz6OIfXE_j90d0NMzAhnNkeMow7LMP5Iqy-yQ8)
Les contre ou ne-se-prononcent-pas :
Des mecs qui discutent (très intéressant) d’une FiO2 haute en peropératoire :
- Ball L, Lumb AB, Pelosi P. Intraoperative fraction of inspired oxygen: bringing back the focus on patient outcome.Br J Anaesth. 2017 Jul 1;119(1):16-18
- Myles PS, Kurz A. Supplemental oxygen and surgical site infection: getting to the truth. Br J Anaesth. 2017 Jul1;119(1):13-15
Une corrélation entre FiO2 haute en chirurgie carcinologique et mortalité (!!!) [NDE j’en parle dans cette note]:
- Meyhoff CS, Jorgensen LN, Wetterslev J, Christensen KB,Rasmussen LS; PROXI Trial Group. Increased long-term mortality after a high perioperative inspiratory oxygen fractionduring abdominal surgery: follow-up of a randomized clinicaltrial. Anesth Analg 2012; 115: 849–54
Les autres mécanismes de la toxicité de l’oxygène : vasoconstriction et modulation de la réponse inflammatoire.En effet, mon billet a été un peu réducteur (et oxydant..) en évoquant uniquement l’aspect des espèces réactives de l’oxygène, car se voulant simple et pratique, mais la réalité est beaucoup plus complexe (dans les paragraphes discussion de ces articles) :
- Chu DK, Kim LH, Young PJ, Zamiri N, Almenawer SA, Jaeschke R, et al. Mortality and morbidity in acutely ill adults treated with liberal versus conservative oxygen therapy (IOTA): a systematic review and meta-analysis. Lancet. 2018 Apr 28;391(10131):1693-1705
- Girardis M, Busani S, Damiani E, Donati A, Rinaldi L, Marudi A, et al. Effect of Conservative vs Conventional Oxygen Therapy on Mortality Among Patients in an Intensive Care Unit: The Oxygen-ICU Randomized Clinical Trial.JAMA. 2016 Oct 18;316(15):1583-1589
La toxicité pulmonaire de l’hyperoxie, le lien avec certaines bactéries (les papiers de Sophie et Karim 😊 ), et la dernière étude sur le SDRA :
- Six S, Jaffal K, Ledoux G, Jaillette E, Wallet F, Nseir S.Hyperoxemia as a risk factor for ventilator-associated pneumonia. Crit Care. 2016 Jun 22;20(1):195
- Jaffal K, Six S, Zerimech F, Nseir S. Is hyperoxaemia a risk factor for ICU-acquired pneumonia? Lancet Respir Med. 2017 May;5(5):e16
- Aggarwal NR, Brower RG, Hager DN, Thompson BT, Netzer G, Shanholtz C, et al. Oxygen Exposure Resulting in Arterial Oxygen Tensions Above the Protocol Goal Was Associated With Worse Clinical Outcomes in Acute Respiratory Distress Syndrome. Crit Care Med. 2018 Apr;46(4):517-524
L’hyperoxémie dans les 24 premières heures et l’évolution neurologique dans les hémorragies sous-arachnoidiennes :
- Yokoyama S, Hifumi T, Kawakita K, Tamiya T, Minamino T, Kuroda Y. Early Hyperoxia in The Intensive Care Unit is Significantly Associated With Unfavorable Neurological Outcomes in Patients With Mild-to-Moderate Aneurysmal Subarachnoid Hemorrhage. Shock. 2019 May;51(5):593-598
L’hyperoxémie dans les premières heures de la prise en charge au déchocage et la mortalité :
- Page D, Ablordeppey E, Wessman BT, Mohr NM, TrzeciakS, Kollef MH, et al. Emergency department hyperoxia is associated with increased mortality in mechanically ventilated patients: a cohort study. Crit Care. 2018 Jan 18;22(1):9
C’est comme l’eau ? (oui mais pas trop), le sel ? (oui mais pas trop), l’insuline ? (oui mais pas trop), le remplissage vasculaire ? (oui mais pas trop), la noradrénaline ? (oui mais pas trop), la vancomycine ? (oui mais pas trop), le LASILIX ? (oui mais pas trop), l’exercice physique ? (oui mais pas trop)[note de l’éditeur il y aurait il une petite provocation ici ?!], le volume courant ? (oui mais pas trop), la PEEP ? (oui mais pas trop).
–
L’oxygène ? oui mais pas trop.
Références :
1) Global guidelines on the prevention of surgical site infection. World Health Organization. 2016. https://www.who.int/gpsc/ssi-prevention-guidelines/en/
2) de Jonge S, Egger M, Latif A, Loke YK, Berenholtz S, Boermeester M, et al. Effectiveness of 80% vs 30-35% fraction of inspired oxygen in patients undergoing surgery: an updated systematic review and meta-analysis. Br J Anaesth. 2019 Mar;122(3):325-334
3) O’Driscoll BR. BTS guideline for oxygen use in adults in healthcare and emergency settings. Thorax. 2015. La version 2015 n’est plus trouvable à part via le lien suivant, car réactualisée par la version 2017. http://www1.mans.edu.eg/facmed/units/MICC/micc-new/pdf/oxygen%20BTS%202015.pdf
4) Staehr-Rye AK, Meyhoff CS, Scheffenbichler FT, Vidal Melo MF, Gätke MR, Walsh JL, et al. High intraoperative inspiratory oxygen fraction and risk of major respiratory complications. Br J Anaesth. 2017 Jul 1;119(1):140-149
5) Girardis M, Busani S, Damiani E, Donati A, Rinaldi L, Marudi A, et al. Effect of Conservative vs Conventional Oxygen Therapy on Mortality Among Patients in an Intensive Care Unit: The Oxygen-ICU Randomized Clinical Trial.JAMA. 2016 Oct 18;316(15):1583-1589
6) Asfar P, Schortgen F, Boisramé-Helms J, et al. Hyperoxia and hypertonic saline in patients with septic shock (HYPERS2S): a two-by-two factorial, multicentre, randomised, clinical trial. Lancet Respir Med 2017; 5:180–190
7) Chu DK, Kim LH, Young PJ, Zamiri N, Almenawer SA, Jaeschke R, et al. Mortality and morbidity in acutely ill adults treated with liberal versus conservative oxygen therapy (IOTA): a systematic review and meta-analysis. Lancet. 2018 Apr 28;391(10131):1693-1705
8) Manley BJ, Owen LS, Hooper SB, Jacobs SE, Cheong JLY, Doyle LW, et al. Towards evidence-based resuscitation of the newborn infant. Lancet. 2017 Apr 22;389(10079):1639-1648
9) Dupic L, Huet O, Harrois A, Duranteau J. Hypoxie et fonction mitochondriale. Réanimation 2010; 19 (5):399-405.
10) Siemieniuk RAC, Chu DK, Kim LH, Güell-Rous MR, Alhazzani W, Soccal PM, et al. Oxygen therapy for acutely ill medical patients: a clinical practice guideline. BMJ. 2018 Oct 24;363:k4169
6 réponses sur « L’oxygène au bloc et en soins critiques »
Merci aux différentes personnes qui ont relu et corrigé ce billet avant sa diffusion, permettant un style d’écriture adapté (enfin j’espère…) à chaque corps de métier soignant (IDE, IADE, interne DESAR, MAR, PU) : Marie L., Nora M., Laetitia K., Marouane M., Rémi F., Benjamin C., Alexandre T., Éric K.
Update quant à la FiO2 à administrer en peropératoire et SSPI :
Reco BJA octobre 2019 : https://bjanaesthesia.org/article/S0007-0912(19)30647-6/fulltext#tbl1
. en peropératoire : après intubation, FiO2 ou = à 94%
. en SSPI : éviter l’administration systématique d’O2, en administrer si SpO2 < 94% en air ambiant
Erratum de copier/coller/mise en forme/codage : après intubation, FiO2 inf. ou = à 40%, puis diminuer au max qsp SpO2 sup. ou = à 94%
Update :
2 RCT publiées dans le NEJM ce mois-ci :
. ICU-ROX : https://www.nejm.org/doi/full/10.1056/NEJMoa1903297
. LOCO2 : https://www.nejm.org/doi/full/10.1056/NEJMoa1916431
1 édito sur ces 2 RCT :
https://www.nejm.org/doi/full/10.1056/NEJMe2000800
-> conclusion dans l’ARDS : pas trop bas
Pour passionné.e.s :
Malheureusement l’étude en elle-même n’apporte pas beaucoup de résultats, car manque de puissance et nombreux biais, mais elle est extraordinairement intéressante.
https://link.springer.com/article/10.1007/s00134-020-06196-y
Hyperoxémie et trauma
À suivre…
https://ccforum.biomedcentral.com/articles/10.1186/s13054-020-03274-x