Deux discussions coup sur coup sur le même sujet, c’est une invitation à écrire un billet de blog. Mon laïus était prêt à se dérouler dans ma tête : je ne fais pas d’obstétrique, j’ai lu un micro vs macrocirculation , la néo c’est de la merde, bla-bla-bla.
Et puis, au hasard d’un moment de glandouille, j’ai lancé un pubmed sur la phenylephrine (dci de Néosynéphrine) et j’ai commencé à me poser des questions. J’ai véritablement découvert quelques trucs qui changent ma vision des choses. Ainsi, je peux vous faire la double conclusion dans l’intro : bloguer m’a obligé à remettre en question mes dogmes et la littérature sur ce sujet est une bonne illustration que camper sur ses positions, c’est un peu con.
J’ai commencé par me coltiner quelques articles sur l’hémodynamique pendant la rachianesthésie pour césarienne. Clairement, ça ne m’a pas super excité : la Néosynéphrine fait mieux que l’éphédrine pour le bébé. Le même auteur (Ngan Kee) qui avait publié le gros essai gamechanger ephedrine vs neo se lance maintenant dans le débat noradré vs néo. On frôle la sodomie de diptère, mais la conversation de fond est intéressante : comment bien perfuser les organes lorsque nos interventions ou la maladie font chuter la pression artérielle.
La rachianesthésie fait baisser la pression artérielle. Les anesthésiques locaux injectés dans le liquide cérébrospinale bloquent la conduction nerveuse. Le tonus sympathique de base qui maintenait en tension le réservoir veineux est perdu. Les artérioles se dilatent également. Les résistances vasculaires systémiques (RVS) chutent.
Chez le sujet sain, cette baisse des RVS induit une petite augmentation du débit cardiaque . Et là où ça devient marrant c’est que nous constatons tous une baisse de la pression artérielle mesurée sur l’artère humérale
Loi d’Ohm : U = RI. Malgré la petite augmentation du débit cardiaque (le I de l’équation), la chute importante que je ne le pensais .
De façon connexe, on ne peut échapper au débat de la qualité des mesures que nous faisons en médecine. Le monitoring de l’hémodynamique reste quelque chose d’assez touchy : continu vs discontinu, invasif vs non-invasif, que devient la qualité des mesures (non invasives) avec nos puissantes drogues ?
La qualité des mesures. Nous y voilà. Savoir critiquer nos mesures, voilà un point clé du métier de l’anesthésiste-réanimateur. Contrairement au pilote d’avion , notre monitoring doit être continuellement remis en question. Et voici une illustration :
Grâce à une utilisation de pubmed en mode bourrin ((« phenylephrine »[MeSH Terms] OR « phenylephrine »[All Fields]) AND (« anaesthesia »[All Fields] OR « anesthesia »[MeSH Terms] OR « anesthesia »[All Fields])) AND (« 2010/12/30″[PDat] : « 2015/12/28″[PDat] AND « humans »[MeSH Terms] AND English[lang]) j’ai trouvé des articles qui donnait le change au pavé dans la mare de Meng & Cannesson dans le BJA en 2011.
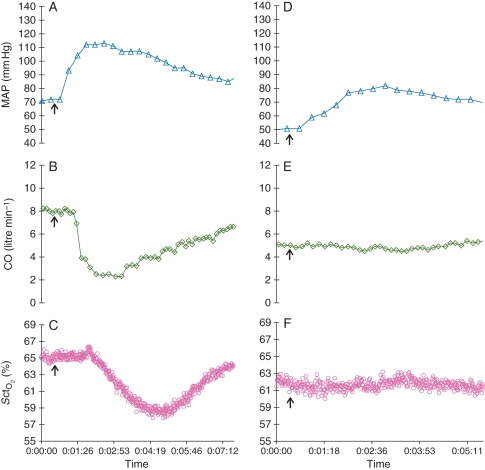
Ce dernier article est celui dont je parlais dans l’intro. Lors d’une anesthésie générale (majoritairement de la chirurgie urologique), la surveillance de l’oxygénation cérébrale (ScO2) par la NIRS chutait lors d’une injection de phényléphrine pour monter la pression artérielle contrairement au groupe éphédrine.
Continuous MAP, CO, and recordings from two selected patients. (a–c) Recordings during phenylephrine treatment. (d–f) Recordings during ephedrine treatment. Both agents were given during the first treatment. Vertical arrows indicate the drug administration time.
En fait, plusieurs auteurs ont par la suite remis en question cette mesure de la ScO2. Chez d’autres sujets (majoritairement sains, au labo) recevant de la phenylephrine, les mesures döppler des vaisseaux dépendant de la carotide interne ou de la carotide externe traduisent plutôt une augmentation des vitesses vers le cerveau et une moindre vélocité vers la peau .
Ainsi, il existe une critique de la mesure de la NIRS après administration de phenylephrine. Et, il faut aller encore plus loin et creuser grâce à la réflexion et la physiologie. Il a été « extrapolé » que cette diminution de la perfusion cutanée pourrait créer ces artéfacts de mesures et on peut se reposer des questions sur l’article du BJA de 2011… mais une vitesse mesurée au döppler ne varie pas réciproquement avec le débit surtout si le diamètre du tuyau varie considérablement (pincez un tuyau d’arrosage vraiment fort et observez). J’en reviens donc un peu au même point mais le voyage vallait le détour 😉
(au fait comment peut-on croire à la NIRS ? juste avec du bon sens paysan hein ? comment peut-on mesurer l’oxygénation du cerveau avec une électrode sur le front ? Le peu de fois où j’ai utilisé ça je n’y comprenais rien, et vous, qu’en pensez-vous ? encore un sujet à potasser…)
Bref. Encore beaucoup de questions… mais j’ai repris une petite claque de rappel sur la nécessité de lire, lire et toujours lire.
Aujourd’hui, si j’ai une baisse de la pression artérielle au bloc opératoire je n’utilise toujours pas la Néosynéphrine mais cette petite plongée dans la littérature m’a rendu un peu moins con. Les articles de revue publiés dans Anesthesia Analgesia en 2011 proposés par Cayetanensis sont des petits bijoux.
En bonus, je me suis amusé avec deux outils pour réfléchir sur le sujet, Gingko App conseillé par Renaud que j’aime bien pour sa simplicité et sa rapidité et MindMeister pour le plaisir de la découverte.
858234
MNXWSAUU
items
1
0
default
asc
Thiele
6611
https://www.nfkb0.com/wp-content/plugins/zotpress/
%7B%22status%22%3A%22success%22%2C%22updateneeded%22%3Afalse%2C%22instance%22%3A%22zotpress-362e5723b3e06884271d83998ee8cef3%22%2C%22meta%22%3A%7B%22request_last%22%3A0%2C%22request_next%22%3A0%2C%22used_cache%22%3Atrue%7D%2C%22data%22%3A%5B%7B%22key%22%3A%22DTCRHU4V%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Goertz%20et%20al.%22%2C%22parsedDate%22%3A%221993-05%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%201.35%3B%20%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%20style%3D%5C%22clear%3A%20left%3B%20%5C%22%3E%5Cn%20%20%20%20%3Cdiv%20class%3D%5C%22csl-left-margin%5C%22%20style%3D%5C%22float%3A%20left%3B%20padding-right%3A%200.5em%3B%20text-align%3A%20right%3B%20width%3A%201em%3B%5C%22%3E1.%3C%5C%2Fdiv%3E%3Cdiv%20class%3D%5C%22csl-right-inline%5C%22%20style%3D%5C%22margin%3A%200%20.4em%200%201.5em%3B%5C%22%3EGoertz%20AW%2C%20Lindner%20KH%2C%20Seefelder%20C%2C%20Schirmer%20U%2C%20Beyer%20M%2C%20Georgieff%20M.%20Effect%20of%20phenylephrine%20bolus%20administration%20on%20global%20left%20ventricular%20function%20in%20patients%20with%20coronary%20artery%20disease%20and%20patients%20with%20valvular%20aortic%20stenosis.%20Anesthesiology.%201993%20May%3B78%285%29%3A834%26%23x2013%3B41.%3C%5C%2Fdiv%3E%5Cn%20%20%20%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Effect%20of%20phenylephrine%20bolus%20administration%20on%20global%20left%20ventricular%20function%20in%20patients%20with%20coronary%20artery%20disease%20and%20patients%20with%20valvular%20aortic%20stenosis%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22A.%20W.%22%2C%22lastName%22%3A%22Goertz%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22K.%20H.%22%2C%22lastName%22%3A%22Lindner%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22C.%22%2C%22lastName%22%3A%22Seefelder%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22U.%22%2C%22lastName%22%3A%22Schirmer%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22M.%22%2C%22lastName%22%3A%22Beyer%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22M.%22%2C%22lastName%22%3A%22Georgieff%22%7D%5D%2C%22abstractNote%22%3A%22BACKGROUND%3A%20Although%20phenylephrine%20bolus%20administration%20is%20frequently%20used%20to%20increase%20coronary%20perfusion%20pressure%20in%20patients%20with%20coronary%20artery%20disease%20or%20valvular%20aortic%20stenosis%2C%20there%20are%20no%20data%20describing%20its%20effect%20on%20left%20ventricular%20function%20%28LVF%29.%5CnMETHODS%3A%20Twenty%20patients%20scheduled%20for%20elective%20coronary%20artery%20bypass%20grafting%20%28group%201%29%20and%2018%20patients%20scheduled%20for%20elective%20aortic%20valve%20replacement%20%28group%202%29%20entered%20the%20study.%20The%20effect%20of%20phenylephrine%20was%20compared%20with%20that%20of%20norepinephrine%20in%20those%20patients%20who%20developed%20a%20defined%20degree%20of%20arterial%20hypotension%20under%20general%20anesthesia.%20These%20patients%20were%20randomized%20to%20receive%20an%20initial%20bolus%20of%20either%20phenylephrine%20%281%20micrograms%5C%2Fkg%29%20or%20norepinephrine%20%280.05%20micrograms%5C%2Fkg%29%20followed%20by%20a%20bolus%20of%20the%20other%20drug%20after%20arterial%20pressure%20and%20heart%20rate%20%28HR%29%20had%20returned%20to%20baseline.%20Transesophageal%20echocardiography%20was%20used%20to%20evaluate%20LVF.%20Arterial%20pressure%2C%20HR%2C%20ejection%20time%2C%20and%20LV%20diameter%2C%20area%2C%20and%20wall%20thickness%20were%20recorded%20immediately%20before%20and%20for%203%20min%20after%20bolus%20administration.%20Fractional%20diameter%20shortening%2C%20fractional%20area%20change%2C%20mean%20heart%20rate%20corrected%20velocity%20of%20circumferential%20fiber%20shortening%20%28mVcfc%29%2C%20and%20LV%20meridional%20end-systolic%20wall%20stress%20%28ESWS%29%20were%20calculated.%5CnRESULTS%3A%20Both%20substances%20effectively%20restored%20arterial%20pressure%20in%20both%20groups.%20However%2C%20in%20group%201%2C%20phenylephrine%20administration%20resulted%20in%20a%20reduction%20of%20fractional%20area%20change%20from%200.51%20%28median%29%20to%200.39%20%28P%20%3D%200.0007%29%20and%20a%20reduction%20of%20mVcfc%20from%201.16%20to%200.61%20circ%5C%2Fs%20%28P%20%3D%200.0001%29.%20End-systolic%20wall%20stress%20increased%20from%2098%20to%20186%2010%283%29%20dyne-cm-2%20%28P%20%3D%200.0001%29.%20Administration%20of%20norepinephrine%20to%20group%201%20and%20administration%20of%20either%20substance%20to%20the%20group%202%20patients%20did%20not%20cause%20any%20significant%20changes%20of%20LVF.%5CnCONCLUSIONS%3A%20The%20results%20indicate%20that%20phenylephrine%20given%20as%20an%20intravenous%20bolus%20to%20patients%20with%20CAD%20anesthetized%20with%20fentanyl%20causes%20a%20transient%20impairment%20of%20LV%20global%20function%20and%20that%20phenylephrine%20bolus%20administration%20is%20well%20tolerated%20in%20patients%20with%20valvular%20aortic%20stenosis.%22%2C%22date%22%3A%22May%201993%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%22%22%2C%22ISSN%22%3A%220003-3022%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22MNXWSAUU%22%5D%2C%22dateModified%22%3A%222015-12-30T09%3A47%3A59Z%22%7D%7D%2C%7B%22key%22%3A%22CE8QZ9IG%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Meng%20et%20al.%22%2C%22parsedDate%22%3A%222011-08%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%201.35%3B%20%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%20style%3D%5C%22clear%3A%20left%3B%20%5C%22%3E%5Cn%20%20%20%20%3Cdiv%20class%3D%5C%22csl-left-margin%5C%22%20style%3D%5C%22float%3A%20left%3B%20padding-right%3A%200.5em%3B%20text-align%3A%20right%3B%20width%3A%201em%3B%5C%22%3E1.%3C%5C%2Fdiv%3E%3Cdiv%20class%3D%5C%22csl-right-inline%5C%22%20style%3D%5C%22margin%3A%200%20.4em%200%201.5em%3B%5C%22%3EMeng%20L%2C%20Cannesson%20M%2C%20Alexander%20BS%2C%20Yu%20Z%2C%20Kain%20ZN%2C%20Cerussi%20AE%2C%20et%20al.%20Effect%20of%20phenylephrine%20and%20ephedrine%20bolus%20treatment%20on%20cerebral%20oxygenation%20in%20anaesthetized%20patients.%20Br%20J%20Anaesth.%202011%20Aug%3B107%282%29%3A209%26%23x2013%3B17.%3C%5C%2Fdiv%3E%5Cn%20%20%20%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Effect%20of%20phenylephrine%20and%20ephedrine%20bolus%20treatment%20on%20cerebral%20oxygenation%20in%20anaesthetized%20patients%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22L.%22%2C%22lastName%22%3A%22Meng%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22M.%22%2C%22lastName%22%3A%22Cannesson%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22B.%20S.%22%2C%22lastName%22%3A%22Alexander%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Z.%22%2C%22lastName%22%3A%22Yu%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Z.%20N.%22%2C%22lastName%22%3A%22Kain%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22A.%20E.%22%2C%22lastName%22%3A%22Cerussi%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22B.%20J.%22%2C%22lastName%22%3A%22Tromberg%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22W.%20W.%22%2C%22lastName%22%3A%22Mantulin%22%7D%5D%2C%22abstractNote%22%3A%22BACKGROUND%3A%20How%20phenylephrine%20and%20ephedrine%20treatments%20affect%20global%20and%20regional%20haemodynamics%20is%20of%20major%20clinical%20relevance.%20Cerebral%20tissue%20oxygen%20saturation%20%28Sct%28O2%29%20%29-guided%20management%20may%20improve%20postoperative%20outcome.%20The%20physiological%20variables%20responsible%20for%20Sct%28O2%29%20changes%20induced%20by%20phenylephrine%20and%20ephedrine%20bolus%20treatment%20in%20anaesthetized%20patients%20need%20to%20be%20defined.%5CnMETHODS%3A%20A%20randomized%20two-treatment%20cross-over%20trial%20was%20conducted%3A%20one%20bolus%20dose%20of%20phenylephrine%20%28100-200%20%5Cu00b5g%29%20and%20one%20bolus%20dose%20of%20ephedrine%20%285-20%20mg%29%20were%20given%20to%2029%20ASA%20I-III%20patients%20anaesthetized%20with%20propofol%20and%20remifentanil.%20%2C%20mean%20arterial%20pressure%20%28MAP%29%2C%20cardiac%20output%20%28CO%29%2C%20and%20other%20physiological%20variables%20were%20recorded%20before%20and%20after%20treatments.%20The%20associations%20of%20changes%20were%20analysed%20using%20linear-mixed%20models.%5CnRESULTS%3A%20The%20CO%20decreased%20significantly%20after%20phenylephrine%20treatment%20%5B%5Cu25b5CO%20%3D%20-2.1%20%281.4%29%20litre%20min%28-1%29%2C%20P%3C0.001%5D%2C%20but%20was%20preserved%20after%20ephedrine%20treatment%20%5B%5Cu25b5CO%20%3D%200.5%20%281.4%29%20litre%20min%28-1%29%2C%20P%3E0.05%5D.%20The%20was%20significantly%20decreased%20after%20phenylephrine%20treatment%20%5B%5Cu25b5%20%3D%20-3.2%20%283.0%29%25%2C%20P%3C0.01%5D%20but%20preserved%20after%20ephedrine%20treatment%20%5B%5Cu25b5%20%3D%200.04%20%281.9%29%25%2C%20P%3E0.05%5D.%20CO%20was%20identified%20to%20have%20the%20most%20significant%20association%20with%20%28P%3C0.001%29.%20After%20taking%20CO%20into%20consideration%2C%20the%20other%20physiological%20variables%2C%20including%20MAP%2C%20were%20not%20significantly%20associated%20with%20%28P%3E0.05%29.%5CnCONCLUSIONS%3A%20Associated%20with%20changes%20in%20CO%2C%20decreased%20after%20phenylephrine%20treatment%2C%20but%20remained%20unchanged%20after%20ephedrine%20treatment.%20The%20significant%20correlation%20between%20CO%20and%20implies%20a%20cause-effect%20relationship%20between%20global%20and%20regional%20haemodynamics.%22%2C%22date%22%3A%22Aug%202011%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1093%5C%2Fbja%5C%2Faer150%22%2C%22ISSN%22%3A%221471-6771%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22MNXWSAUU%22%5D%2C%22dateModified%22%3A%222015-12-26T08%3A08%3A42Z%22%7D%7D%2C%7B%22key%22%3A%22RDCT3EJT%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Meng%20et%20al.%22%2C%22parsedDate%22%3A%222012-05%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%201.35%3B%20%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%20style%3D%5C%22clear%3A%20left%3B%20%5C%22%3E%5Cn%20%20%20%20%3Cdiv%20class%3D%5C%22csl-left-margin%5C%22%20style%3D%5C%22float%3A%20left%3B%20padding-right%3A%200.5em%3B%20text-align%3A%20right%3B%20width%3A%201em%3B%5C%22%3E1.%3C%5C%2Fdiv%3E%3Cdiv%20class%3D%5C%22csl-right-inline%5C%22%20style%3D%5C%22margin%3A%200%20.4em%200%201.5em%3B%5C%22%3EMeng%20L%2C%20Gelb%20AW%2C%20Alexander%20BS%2C%20Cerussi%20AE%2C%20Tromberg%20BJ%2C%20Yu%20Z%2C%20et%20al.%20Impact%20of%20phenylephrine%20administration%20on%20cerebral%20tissue%20oxygen%20saturation%20and%20blood%20volume%20is%20modulated%20by%20carbon%20dioxide%20in%20anaesthetized%20patients.%20Br%20J%20Anaesth.%202012%20May%3B108%285%29%3A815%26%23x2013%3B22.%3C%5C%2Fdiv%3E%5Cn%20%20%20%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Impact%20of%20phenylephrine%20administration%20on%20cerebral%20tissue%20oxygen%20saturation%20and%20blood%20volume%20is%20modulated%20by%20carbon%20dioxide%20in%20anaesthetized%20patients%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22L.%22%2C%22lastName%22%3A%22Meng%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22A.%20W.%22%2C%22lastName%22%3A%22Gelb%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22B.%20S.%22%2C%22lastName%22%3A%22Alexander%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22A.%20E.%22%2C%22lastName%22%3A%22Cerussi%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22B.%20J.%22%2C%22lastName%22%3A%22Tromberg%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Z.%22%2C%22lastName%22%3A%22Yu%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22W.%20W.%22%2C%22lastName%22%3A%22Mantulin%22%7D%5D%2C%22abstractNote%22%3A%22BACKGROUND%3A%20Multiple%20studies%20have%20shown%20that%20cerebral%20tissue%20oxygen%20saturation%20%28Sct%28O%282%29%29%29%20is%20decreased%20after%20phenylephrine%20treatment.%20We%20hypothesized%20that%20the%20negative%20impact%20of%20phenylephrine%20administration%20on%20Sct%28O%282%29%29%20is%20affected%20by%20arterial%20blood%20carbon%20dioxide%20partial%20pressure%20%28Pa%28CO%282%29%29%29%20because%20CO%282%29%20is%20a%20powerful%20modulator%20of%20cerebrovascular%20tone.%5CnMETHODS%3A%20In%2014%20anaesthetized%20healthy%20patients%2C%20i.v.%20phenylephrine%20bolus%20was%20administered%20to%20increase%20the%20mean%20arterial%20pressure%20~20-30%25%20during%20hypocapnia%2C%20normocapnia%2C%20and%20hypercapnia.%20Sct%28O%282%29%29%20and%20cerebral%20blood%20volume%20%28CBV%29%20were%20measured%20using%20frequency%20domain%20near-infrared%20spectroscopy%2C%20a%20quantitative%20technology.%20Data%20collection%20occurred%20before%20and%20after%20each%20treatment.%5CnRESULTS%3A%20Phenylephrine%20caused%20a%20significant%20decrease%20in%20Sct%28O%282%29%29%20during%20hypocapnia%20%5B%5Cu0394Sct%28O%282%29%29%20%3D-3.4%20%281.5%29%25%2C%20P%3C0.001%5D%2C%20normocapnia%20%5B%5Cu0394Sct%28O%282%29%29%20%3D-2.4%20%281.5%29%25%2C%20P%3C0.001%5D%2C%20and%20hypercapnia%20%5B%5Cu0394Sct%28O%282%29%29%20%3D-1.4%20%281.5%29%25%2C%20P%3C0.01%5D.%20Decreases%20in%20Sct%28O%282%29%29%20were%20significantly%20different%20between%20hypocapnia%2C%20normocapnia%2C%20and%20hypercapnia%20%28P%3C0.001%29.%20Phenylephrine%20also%20caused%20a%20significant%20decrease%20in%20CBV%20during%20hypocapnia%20%28P%3C0.01%29%2C%20but%20not%20during%20normocapnia%20or%20hypercapnia.%5CnCONCLUSION%3A%20The%20negative%20impact%20of%20phenylephrine%20treatment%20on%20Sct%28O%282%29%29%20and%20CBV%20is%20intensified%20during%20hypocapnia%20while%20blunted%20during%20hypercapnia.%22%2C%22date%22%3A%22May%202012%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1093%5C%2Fbja%5C%2Faes023%22%2C%22ISSN%22%3A%221471-6771%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22MNXWSAUU%22%5D%2C%22dateModified%22%3A%222015-12-26T08%3A07%3A01Z%22%7D%7D%2C%7B%22key%22%3A%22MQF885K3%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Thiele%20et%20al.%22%2C%22parsedDate%22%3A%222011-08%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%201.35%3B%20%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%20style%3D%5C%22clear%3A%20left%3B%20%5C%22%3E%5Cn%20%20%20%20%3Cdiv%20class%3D%5C%22csl-left-margin%5C%22%20style%3D%5C%22float%3A%20left%3B%20padding-right%3A%200.5em%3B%20text-align%3A%20right%3B%20width%3A%201em%3B%5C%22%3E1.%3C%5C%2Fdiv%3E%3Cdiv%20class%3D%5C%22csl-right-inline%5C%22%20style%3D%5C%22margin%3A%200%20.4em%200%201.5em%3B%5C%22%3E%3Cstrong%3EThiele%3C%5C%2Fstrong%3E%20RH%2C%20Nemergut%20EC%2C%20Lynch%20C.%20The%20physiologic%20implications%20of%20isolated%20alpha%281%29%20adrenergic%20stimulation.%20Anesth%20Analg.%202011%20Aug%3B113%282%29%3A284%26%23x2013%3B96.%3C%5C%2Fdiv%3E%5Cn%20%20%20%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22The%20physiologic%20implications%20of%20isolated%20alpha%281%29%20adrenergic%20stimulation%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Robert%20H.%22%2C%22lastName%22%3A%22Thiele%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Edward%20C.%22%2C%22lastName%22%3A%22Nemergut%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Carl%22%2C%22lastName%22%3A%22Lynch%22%7D%5D%2C%22abstractNote%22%3A%22Phenylephrine%20and%20methoxamine%20are%20direct-acting%2C%20predominantly%20%5Cu03b1%281%29%20adrenergic%20receptor%20%28AR%29%20agonists.%20To%20better%20understand%20their%20physiologic%20effects%2C%20we%20screened%20463%20articles%20on%20the%20basis%20of%20PubMed%20searches%20of%20%5C%22methoxamine%5C%22%20and%20%5C%22phenylephrine%5C%22%20%28limited%20to%20human%2C%20randomized%20studies%20published%20in%20English%29%2C%20as%20well%20as%20citations%20found%20therein.%20Relevant%20articles%2C%20as%20well%20as%20those%20discovered%20in%20the%20peer-review%20process%2C%20were%20incorporated%20into%20this%20review.%20Both%20methoxamine%20and%20phenylephrine%20increase%20cardiac%20afterload%20via%20several%20mechanisms%2C%20including%20increased%20vascular%20resistance%2C%20decreased%20vascular%20compliance%2C%20and%20disadvantageous%20alterations%20in%20the%20pressure%20waveforms%20produced%20by%20the%20pulsatile%20heart.%20Although%20pure%20%5Cu03b1%281%29%20agonists%20increase%20arterial%20blood%20pressure%2C%20neither%20animal%20nor%20human%20studies%20have%20ever%20shown%20pure%20%5Cu03b1%281%29-agonism%20to%20produce%20a%20favorable%20change%20in%20myocardial%20energetics%20because%20of%20the%20resultant%20increase%20in%20myocardial%20workload.%20Furthermore%2C%20the%20cost%20of%20increased%20blood%20pressure%20after%20pure%20%5Cu03b1%281%29-agonism%20is%20almost%20invariably%20decreased%20cardiac%20output%2C%20likely%20due%20to%20increases%20in%20venous%20resistance.%20The%20venous%20system%20contains%20%5Cu03b1%281%29%20ARs%2C%20and%20though%20stimulation%20of%20%5Cu03b1%281%29%20ARs%20decreases%20capacitance%20and%20may%20transiently%20increase%20venous%20return%2C%20this%20gain%20may%20be%20offset%20by%20changes%20in%20afterload%2C%20venous%20compliance%2C%20and%20venous%20resistance.%20Data%20on%20the%20effects%20of%20%5Cu03b1%281%29%20stimulation%20in%20the%20central%20nervous%20system%20show%20conflicting%20changes%2C%20while%20experimental%20animal%20data%20suggest%20that%20renal%20blood%20flow%20is%20reduced%20by%20%5Cu03b1%281%29-agonists%2C%20and%20both%20animal%20and%20human%20data%20suggest%20that%20gastrointestinal%20perfusion%20may%20be%20reduced%20by%20%5Cu03b1%281%29%20tone.%22%2C%22date%22%3A%22Aug%202011%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1213%5C%2FANE.0b013e3182124c0e%22%2C%22ISSN%22%3A%221526-7598%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22MNXWSAUU%22%5D%2C%22dateModified%22%3A%222015-12-26T08%3A03%3A58Z%22%7D%7D%2C%7B%22key%22%3A%22E3KD3CNX%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Thiele%20et%20al.%22%2C%22parsedDate%22%3A%222011-08%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%201.35%3B%20%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%20style%3D%5C%22clear%3A%20left%3B%20%5C%22%3E%5Cn%20%20%20%20%3Cdiv%20class%3D%5C%22csl-left-margin%5C%22%20style%3D%5C%22float%3A%20left%3B%20padding-right%3A%200.5em%3B%20text-align%3A%20right%3B%20width%3A%201em%3B%5C%22%3E1.%3C%5C%2Fdiv%3E%3Cdiv%20class%3D%5C%22csl-right-inline%5C%22%20style%3D%5C%22margin%3A%200%20.4em%200%201.5em%3B%5C%22%3E%3Cstrong%3EThiele%3C%5C%2Fstrong%3E%20RH%2C%20Nemergut%20EC%2C%20Lynch%20C.%20The%20clinical%20implications%20of%20isolated%20alpha%281%29%20adrenergic%20stimulation.%20Anesth%20Analg.%202011%20Aug%3B113%282%29%3A297%26%23x2013%3B304.%3C%5C%2Fdiv%3E%5Cn%20%20%20%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22The%20clinical%20implications%20of%20isolated%20alpha%281%29%20adrenergic%20stimulation%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Robert%20H.%22%2C%22lastName%22%3A%22Thiele%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Edward%20C.%22%2C%22lastName%22%3A%22Nemergut%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Carl%22%2C%22lastName%22%3A%22Lynch%22%7D%5D%2C%22abstractNote%22%3A%22Phenylephrine%20is%20a%20direct-acting%2C%20predominantly%20%5Cu03b1%281%29%20adrenergic%20receptor%20agonist%20used%20by%20anesthesiologists%20and%20intensivists%20to%20treat%20hypotension.%20A%20variety%20of%20physiologic%20studies%20suggest%20that%20%5Cu03b1-agonists%20increase%20cardiac%20afterload%2C%20reduce%20venous%20compliance%2C%20and%20reduce%20renal%20bloodflow.%20The%20effects%20on%20gastrointestinal%20and%20cerebral%20perfusion%20are%20controversial.%20To%20better%20understand%20the%20effects%20of%20phenylephrine%20in%20a%20variety%20of%20clinical%20settings%2C%20we%20screened%20463%20articles%20on%20the%20basis%20of%20PubMed%20searches%20of%20%5C%22methoxamine%2C%5C%22%20a%20long-acting%20%5Cu03b1%20agonist%2C%20and%20%5C%22phenylephrine%5C%22%20%28limited%20to%20human%2C%20randomized%20studies%20published%20in%20English%29%2C%20as%20well%20as%20citations%20found%20therein.%20Relevant%20articles%2C%20as%20well%20as%20those%20discovered%20in%20the%20peer-review%20process%2C%20were%20incorporated%20into%20this%20review.%20Phenylephrine%20has%20been%20studied%20as%20an%20antihypotensive%20drug%20in%20patients%20with%20severe%20aortic%20stenosis%2C%20as%20a%20treatment%20for%20decompensated%20tetralogy%20of%20Fallot%20and%20hypoxemia%20during%201-lung%20ventilation%2C%20as%20well%20as%20for%20the%20treatment%20of%20septic%20shock%2C%20traumatic%20brain%20injury%2C%20vasospasm%20status-postsubarachnoid%20hemorrhage%2C%20and%20hypotension%20during%20cesarean%20delivery.%20In%20specific%20instances%20%28critical%20aortic%20stenosis%2C%20tetralogy%20of%20Fallot%2C%20hypotension%20during%20cesarean%20delivery%29%20in%20which%20the%20regional%20effects%20of%20phenylephrine%20%28e.g.%2C%20decreased%20heart%20rate%2C%20favorable%20alterations%20in%20Q%28p%29%3AQ%28s%29%20ratio%2C%20improved%20fetal%20oxygen%20supply%3Ademand%20ratio%29%20outweigh%20its%20global%20effects%20%28e.g.%2C%20decreased%20cardiac%20output%29%2C%20phenylephrine%20may%20be%20a%20rational%20pharmacologic%20choice.%20In%20pathophysiologic%20states%20in%20which%20no%20regional%20advantages%20are%20gained%20by%20using%20an%20%5Cu03b1%281%29%20agonist%2C%20alternative%20vasopressors%20should%20be%20sought.%22%2C%22date%22%3A%22Aug%202011%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1213%5C%2FANE.0b013e3182120ca5%22%2C%22ISSN%22%3A%221526-7598%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22MNXWSAUU%22%5D%2C%22dateModified%22%3A%222015-12-26T08%3A03%3A46Z%22%7D%7D%2C%7B%22key%22%3A%22J9S88E2H%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Pathak%20et%20al.%22%2C%22parsedDate%22%3A%222013-07%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%201.35%3B%20%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%20style%3D%5C%22clear%3A%20left%3B%20%5C%22%3E%5Cn%20%20%20%20%3Cdiv%20class%3D%5C%22csl-left-margin%5C%22%20style%3D%5C%22float%3A%20left%3B%20padding-right%3A%200.5em%3B%20text-align%3A%20right%3B%20width%3A%201em%3B%5C%22%3E1.%3C%5C%2Fdiv%3E%3Cdiv%20class%3D%5C%22csl-right-inline%5C%22%20style%3D%5C%22margin%3A%200%20.4em%200%201.5em%3B%5C%22%3EPathak%20D%2C%20Pennefather%20SH%2C%20Russell%20GN%2C%20Al%20Rawi%20O%2C%20Dave%20IC%2C%20Gilby%20S%2C%20et%20al.%20Phenylephrine%20infusion%20improves%20blood%20flow%20to%20the%20stomach%20during%20oesophagectomy%20in%20the%20presence%20of%20a%20thoracic%20epidural%20analgesia.%20Eur%20J%20Cardiothorac%20Surg.%202013%20Jul%3B44%281%29%3A130%26%23x2013%3B3.%3C%5C%2Fdiv%3E%5Cn%20%20%20%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Phenylephrine%20infusion%20improves%20blood%20flow%20to%20the%20stomach%20during%20oesophagectomy%20in%20the%20presence%20of%20a%20thoracic%20epidural%20analgesia%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Darshan%22%2C%22lastName%22%3A%22Pathak%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Stephen%20H.%22%2C%22lastName%22%3A%22Pennefather%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Glenn%20N.%22%2C%22lastName%22%3A%22Russell%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Omar%22%2C%22lastName%22%3A%22Al%20Rawi%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22I.%20C.%22%2C%22lastName%22%3A%22Dave%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Susan%22%2C%22lastName%22%3A%22Gilby%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Richard%20D.%22%2C%22lastName%22%3A%22Page%22%7D%5D%2C%22abstractNote%22%3A%22OBJECTIVES%3A%20Gastric%20tube%20necrosis%20is%20a%20major%20cause%20of%20mortality%20after%20oesophagectomy.%20The%20construction%20of%20the%20gastric%20tube%20used%20for%20oesophageal%20reconstruction%20involves%20a%20division%20of%20several%20arteries%20leading%20to%20a%20reduction%20in%20the%20blood%20supply%20at%20the%20fundus%2C%20which%20is%20used%20for%20the%20oesophageal%20anastomosis.%20This%20study%20was%20undertaken%20to%20determine%20the%20effect%20of%20thoracic%20epidural%20anaesthesia%20and%20intravenous%20phenylephrine%20on%20haemodynamics%20and%20blood%20flow%20in%20the%20tubularized%20stomach.%5CnMETHODS%3A%20Ten%20patients%20undergoing%20an%20oesophagectomy%20were%20prospectively%20studied.%20Pulmonary%20artery%20catheters%20were%20used%20to%20measure%20haemodynamic%20changes%2C%20and%20laser%20Doppler%20flow%20probes%20were%20used%20to%20measure%20gastric%20blood%20flow.%20The%20effects%20of%20an%20intraoperative%20thoracic%20epidural%20and%20subsequent%20intravenous%20phenylephrine%20infusion%20were%20documented.%5CnRESULTS%3A%20The%20administration%20of%20a%20thoracic%20epidural%20bolus%20of%20bupivacaine%200.25%25%20at%200.1%20ml%20kg%20resulted%20in%20a%20significant%20reduction%20in%20flux%20at%20the%20anastomotic%20end%20of%20the%20newly%20formed%20gastric%20tube%20from%20a%20median%20of%2057-41%20perfusion%20units%20%28P%20%3D%200.003%29.%20A%20subsequent%20intravenous%20phenylephrine%20infusion%20titrated%20to%20restore%20mean%20arterial%20pressure%20significantly%20increased%20the%20flux%20at%20the%20anastomotic%20end%20from%20a%20median%20of%2041-66%20perfusion%20units%20%28P%20%3D%200.009%29.%5CnCONCLUSIONS%3A%20An%20intravenous%20phenylephrine%20infusion%20can%20reverse%20the%20epidural%20bolus-induced%20reduction%20in%20blood%20flow%20at%20the%20anastomotic%20end%20of%20the%20newly%20formed%20gastric%20tube.%22%2C%22date%22%3A%22Jul%202013%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1093%5C%2Fejcts%5C%2Fezs644%22%2C%22ISSN%22%3A%221873-734X%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22MNXWSAUU%22%5D%2C%22dateModified%22%3A%222015-12-26T08%3A00%3A48Z%22%7D%7D%2C%7B%22key%22%3A%22ZP4ZC3HZ%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Ibrahim%20et%20al.%22%2C%22parsedDate%22%3A%222014-08%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%201.35%3B%20%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%20style%3D%5C%22clear%3A%20left%3B%20%5C%22%3E%5Cn%20%20%20%20%3Cdiv%20class%3D%5C%22csl-left-margin%5C%22%20style%3D%5C%22float%3A%20left%3B%20padding-right%3A%200.5em%3B%20text-align%3A%20right%3B%20width%3A%201em%3B%5C%22%3E1.%3C%5C%2Fdiv%3E%3Cdiv%20class%3D%5C%22csl-right-inline%5C%22%20style%3D%5C%22margin%3A%200%20.4em%200%201.5em%3B%5C%22%3EIbrahim%20AMS%2C%20Kim%20PS%2C%20Rabie%20AN%2C%20Lee%20BT%2C%20Lin%20SJ.%20Vasopressors%20and%20reconstructive%20flap%20perfusion%3A%20a%20review%20of%20the%20literature%20comparing%20the%20effects%20of%20various%20pharmacologic%20agents.%20Ann%20Plast%20Surg.%202014%20Aug%3B73%282%29%3A245%26%23x2013%3B8.%3C%5C%2Fdiv%3E%5Cn%20%20%20%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Vasopressors%20and%20reconstructive%20flap%20perfusion%3A%20a%20review%20of%20the%20literature%20comparing%20the%20effects%20of%20various%20pharmacologic%20agents%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Ahmed%20M.%20S.%22%2C%22lastName%22%3A%22Ibrahim%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Peter%20S.%22%2C%22lastName%22%3A%22Kim%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Amr%20N.%22%2C%22lastName%22%3A%22Rabie%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Bernard%20T.%22%2C%22lastName%22%3A%22Lee%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Samuel%20J.%22%2C%22lastName%22%3A%22Lin%22%7D%5D%2C%22abstractNote%22%3A%22INTRODUCTION%3A%20Use%20of%20intraoperative%20vasopressors%20is%20of%20debate%20in%20microvascular%20surgery.%20Anesthesia%20is%20an%20important%20factor%20in%20maintaining%20the%20rate%20of%20success%20of%20flap%20transfer%20by%20affecting%20regional%20blood%20flow%20and%20global%20hemodynamics.%20We%20conducted%20a%20review%20of%20the%20literature%20comparing%20the%20use%20of%20different%20vasoactive%20agents%20on%20different%20flaps%20in%20various%20human%20and%20animal%20models.%5CnMETHODS%3A%20A%20systematic%20review%20of%20the%20literature%20was%20performed.%20Bibliographies%20of%20key%20articles%20were%20also%20reviewed%20for%20additional%20resources.%20Analysis%20was%20done%20to%20determine%20the%20overall%20trend%20of%20how%20flap%20perfusion%20is%20affected%20by%20the%20use%20of%20intraoperative%20vasoactive%20medication.%5CnRESULTS%3A%20The%20literature%20search%20identified%2016%20relevant%20articles.%20Flaps%20were%20studied%20in%20pigs%20in%207%20studies%2C%20rats%20in%205%2C%20and%20humans%20in%204.%20The%20most%20common%20flap%20was%20the%20rectus%20abdominis%20musculocutaneous%20flap.%20Phenylephrine%20and%20norepinephrine%20were%20the%20most%20common%20pressor%20agents%20used.%20No%20significant%20statistical%20changes%20were%20noted%20in%208%20of%20the%2016%20studies%3B%20initial%20ischemia%20followed%20by%20delayed%20improved%20perfusion%20was%20observed%20in%204%20studies%2C%20%5C%22true%20ischemia%5C%22%20and%20hypoperfusion%20of%20the%20skin%20flaps%20was%20noted%20in%203.%20There%20was%20no%20consistency%20in%20their%20effect%20on%20flap%20perfusion%3A%20initial%20ischemia%20followed%20by%20delayed%20improved%20perfusion%20was%20observed%20in%204%20studies%2C%20whereas%20true%20ischemia%20and%20hypoperfusion%20of%20the%20skin%20flaps%20was%20noted%20in%203.%5CnCONCLUSIONS%3A%20To%20date%2C%20there%20is%20no%20reliable%20prospective%20clinical%20evidence%20that%20supports%20the%20absolute%20contraindication%20of%20pressor%20agents%20during%20free%20flap%20surgery.%20This%20topic%20will%20continue%20to%20be%20a%20matter%20for%20debate%20until%20more%20definitive%20data%20can%20be%20obtained.%22%2C%22date%22%3A%22Aug%202014%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1097%5C%2FSAP.0b013e31828d70b3%22%2C%22ISSN%22%3A%221536-3708%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22MNXWSAUU%22%5D%2C%22dateModified%22%3A%222015-12-26T07%3A59%3A33Z%22%7D%7D%2C%7B%22key%22%3A%22AXA64RXF%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22S%5Cu00f8rensen%20et%20al.%22%2C%22parsedDate%22%3A%222014-09%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%201.35%3B%20%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%20style%3D%5C%22clear%3A%20left%3B%20%5C%22%3E%5Cn%20%20%20%20%3Cdiv%20class%3D%5C%22csl-left-margin%5C%22%20style%3D%5C%22float%3A%20left%3B%20padding-right%3A%200.5em%3B%20text-align%3A%20right%3B%20width%3A%201em%3B%5C%22%3E1.%3C%5C%2Fdiv%3E%3Cdiv%20class%3D%5C%22csl-right-inline%5C%22%20style%3D%5C%22margin%3A%200%20.4em%200%201.5em%3B%5C%22%3ES%26%23xF8%3Brensen%20H%2C%20Rasmussen%20P%2C%20Sato%20K%2C%20Persson%20S%2C%20Olesen%20ND%2C%20Nielsen%20HB%2C%20et%20al.%20External%20carotid%20artery%20flow%20maintains%20near%20infrared%20spectroscopy-determined%20frontal%20lobe%20oxygenation%20during%20ephedrine%20administration.%20Br%20J%20Anaesth.%202014%20Sep%3B113%283%29%3A452%26%23x2013%3B8.%3C%5C%2Fdiv%3E%5Cn%20%20%20%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22External%20carotid%20artery%20flow%20maintains%20near%20infrared%20spectroscopy-determined%20frontal%20lobe%20oxygenation%20during%20ephedrine%20administration%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22H.%22%2C%22lastName%22%3A%22S%5Cu00f8rensen%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22P.%22%2C%22lastName%22%3A%22Rasmussen%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22K.%22%2C%22lastName%22%3A%22Sato%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22S.%22%2C%22lastName%22%3A%22Persson%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22N.%20D.%22%2C%22lastName%22%3A%22Olesen%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22H.%20B.%22%2C%22lastName%22%3A%22Nielsen%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22N.%20V.%22%2C%22lastName%22%3A%22Olsen%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22S.%22%2C%22lastName%22%3A%22Ogoh%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22N.%20H.%22%2C%22lastName%22%3A%22Secher%22%7D%5D%2C%22abstractNote%22%3A%22BACKGROUND%3A%20Phenylephrine%20and%20ephedrine%20affect%20frontal%20lobe%20oxygenation%20%28%5BFormula%3A%20see%20text%5D%29%20differently%20when%20assessed%20by%20spatially%20resolved%20near%20infrared%20spectroscopy.%20We%20evaluated%20the%20effect%20of%20phenylephrine%20and%20ephedrine%20on%20extra-%20vs%20intra-cerebral%20blood%20flow%20and%20on%20%5BFormula%3A%20see%20text%5D.%5CnMETHODS%3A%20In%2010%20healthy%20males%20%28age%2020-54%20yr%29%2C%20phenylephrine%20or%20ephedrine%20was%20infused%20for%20an%20%5Cu223c20%20mm%20Hg%20increase%20in%20mean%20arterial%20pressure.%20Cerebral%20oxygenation%20%28SavO%5Cu2082%29%20was%20calculated%20from%20the%20arterial%20and%20jugular%20bulb%20oxygen%20saturations.%20Blood%20flow%20in%20the%20internal%20carotid%20artery%20%28ICAf%29%20and%20blood%20flow%20in%20the%20external%20carotid%20artery%20%28ECAf%29%20were%20assessed%20by%20duplex%20ultrasonography.%20Invos-5100c%20%28SinvosO%5Cu2082%29%20and%20Foresight%20%28SforeO%5Cu2082%29%20determined%20%5BFormula%3A%20see%20text%5D%20while%20forehead%20skin%20oxygenation%20%28SskinO%5Cu2082%29%20was%20assessed.%5CnRESULTS%3A%20Phenylephrine%20reduced%20SforeO%5Cu2082%20by%206.9%25%20%2895%25%20confidence%20interval%3A%204.8-9.0%25%3B%20P%3C0.0001%29%2C%20SinvosO%5Cu2082%20by%2010.5%20%288.2-12.9%25%3B%20P%3C0.0001%29%2C%20and%20ECAf%20%286-28%25%3B%20P%3D0.0001%29%2C%20but%20increased%20ICAf%20%285-21%25%3B%20P%3D0.003%29%20albeit%20with%20no%20consequence%20for%20SskinO%5Cu2082%20or%20SavO%5Cu2082.%20In%20contrast%2C%20SforeO%5Cu2082%20was%20maintained%20with%20administration%20of%20ephedrine%20while%20SinvosO%5Cu2082%20and%20SavO%5Cu2082%20decreased%20%5Bby%203.1%20%280.7-4.5%25%3B%20P%3D0.017%29%20and%202.1%20%280.5-3.3%25%3B%20P%3D0.012%29%5D%20as%20arterial%20carbon%20dioxide%20pressure%20decreased%20%28P%3D0.003%29.%20ICAf%20was%20stable%20and%20ECAf%20increased%20by%2011%20%284-18%25%3B%20P%3D0.005%29%20with%20administration%20of%20ephedrine%20while%20SskinO%5Cu2082%20did%20not%20change.%5CnCONCLUSIONS%3A%20The%20effect%20of%20phenylephrine%20on%20ScO%5Cu2082%20is%20governed%20by%20a%20decrease%20in%20external%20carotid%20blood%20flow%20since%20it%20increases%20cerebral%20blood%20flow%20as%20determined%20by%20flow%20in%20the%20internal%20carotid%20artery.%20In%20contrast%2C%20ScO%5Cu2082%20is%20largely%20maintained%20with%20administration%20of%20ephedrine%20because%20blood%20flow%20to%20extracerebral%20tissue%20increases.%22%2C%22date%22%3A%22Sep%202014%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1093%5C%2Fbja%5C%2Faet481%22%2C%22ISSN%22%3A%221471-6771%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22MNXWSAUU%22%5D%2C%22dateModified%22%3A%222015-12-26T07%3A51%3A49Z%22%7D%7D%2C%7B%22key%22%3A%22RIU82S7N%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Atkinson%20et%20al.%22%2C%22parsedDate%22%3A%222014-03-20%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%201.35%3B%20%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%20style%3D%5C%22clear%3A%20left%3B%20%5C%22%3E%5Cn%20%20%20%20%3Cdiv%20class%3D%5C%22csl-left-margin%5C%22%20style%3D%5C%22float%3A%20left%3B%20padding-right%3A%200.5em%3B%20text-align%3A%20right%3B%20width%3A%201em%3B%5C%22%3E1.%3C%5C%2Fdiv%3E%3Cdiv%20class%3D%5C%22csl-right-inline%5C%22%20style%3D%5C%22margin%3A%200%20.4em%200%201.5em%3B%5C%22%3EAtkinson%20HC%2C%20Stanescu%20I%2C%20Anderson%20BJ.%20Increased%20phenylephrine%20plasma%20levels%20with%20administration%20of%20acetaminophen.%20N%20Engl%20J%20Med.%202014%20Mar%2020%3B370%2812%29%3A1171%26%23x2013%3B2.%3C%5C%2Fdiv%3E%5Cn%20%20%20%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Increased%20phenylephrine%20plasma%20levels%20with%20administration%20of%20acetaminophen%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Hartley%20C.%22%2C%22lastName%22%3A%22Atkinson%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Ioana%22%2C%22lastName%22%3A%22Stanescu%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Brian%20J.%22%2C%22lastName%22%3A%22Anderson%22%7D%5D%2C%22abstractNote%22%3A%22%22%2C%22date%22%3A%22Mar%2020%2C%202014%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1056%5C%2FNEJMc1313942%22%2C%22ISSN%22%3A%221533-4406%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22MNXWSAUU%22%5D%2C%22dateModified%22%3A%222015-12-26T07%3A50%3A25Z%22%7D%7D%2C%7B%22key%22%3A%22GURRBIXX%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22S%5Cu00f8rensen%20et%20al.%22%2C%22parsedDate%22%3A%222012-08%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%201.35%3B%20%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%20style%3D%5C%22clear%3A%20left%3B%20%5C%22%3E%5Cn%20%20%20%20%3Cdiv%20class%3D%5C%22csl-left-margin%5C%22%20style%3D%5C%22float%3A%20left%3B%20padding-right%3A%200.5em%3B%20text-align%3A%20right%3B%20width%3A%201em%3B%5C%22%3E1.%3C%5C%2Fdiv%3E%3Cdiv%20class%3D%5C%22csl-right-inline%5C%22%20style%3D%5C%22margin%3A%200%20.4em%200%201.5em%3B%5C%22%3ES%26%23xF8%3Brensen%20H%2C%20Secher%20NH%2C%20Siebenmann%20C%2C%20Nielsen%20HB%2C%20Kohl-Bareis%20M%2C%20Lundby%20C%2C%20et%20al.%20Cutaneous%20vasoconstriction%20affects%20near-infrared%20spectroscopy%20determined%20cerebral%20oxygen%20saturation%20during%20administration%20of%20norepinephrine.%20Anesthesiology.%202012%20Aug%3B117%282%29%3A263%26%23x2013%3B70.%3C%5C%2Fdiv%3E%5Cn%20%20%20%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Cutaneous%20vasoconstriction%20affects%20near-infrared%20spectroscopy%20determined%20cerebral%20oxygen%20saturation%20during%20administration%20of%20norepinephrine%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Henrik%22%2C%22lastName%22%3A%22S%5Cu00f8rensen%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Niels%20H.%22%2C%22lastName%22%3A%22Secher%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Christoph%22%2C%22lastName%22%3A%22Siebenmann%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Henning%20B.%22%2C%22lastName%22%3A%22Nielsen%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Matthias%22%2C%22lastName%22%3A%22Kohl-Bareis%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Carsten%22%2C%22lastName%22%3A%22Lundby%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Peter%22%2C%22lastName%22%3A%22Rasmussen%22%7D%5D%2C%22abstractNote%22%3A%22BACKGROUND%3A%20Perioperative%20optimization%20of%20spatially%20resolved%20near-infrared%20spectroscopy%20determined%20cerebral%20frontal%20lobe%20oxygenation%20%28scO2%29%20may%20reduce%20postoperative%20morbidity.%20Norepinephrine%20is%20routinely%20administered%20to%20maintain%20cerebral%20perfusion%20pressure%20and%2C%20thereby%2C%20cerebral%20blood%20flow%2C%20but%20norepinephrine%20reduces%20the%20scO2.%20We%20hypothesized%20that%20norepinephrine-induced%20reduction%20in%20scO2%20is%20influenced%20by%20cutaneous%20vasoconstriction.%5CnMETHODS%3A%20Fifteen%20healthy%20male%20subjects%20%2825%20%5Cu00b1%205%20yr%2C%20mean%20%5Cu00b1%20SD%29%20were%20studied%20during%3A%20hyperventilation%20%281.5%20kPa%20end-tidal%20PcO2%20reduction%29%2C%20whole-body%20heating%2C%20administration%20of%20norepinephrine%20%280.15%20%5Cu03bcg%20%5Cu00b7%20kg%20%5Cu00b7%20min%3B%20with%20and%20without%20end-tidal%20carbon%20dioxide%20correction%29%2C%20and%20hypoxia%20%28FiO2%3A%200.12%25%29.%20Arterial%20%28saO2%29%2C%20skin%2C%20and%20internal%20jugular%20venous%20oxygen%20saturations%20%28sjO2%29%20were%20recorded%2C%20and%20the%20average%20cerebral%20capillary%20oxygen%20saturation%20%28scapO2%29%20was%20calculated.%5CnRESULTS%3A%20This%20study%20indicates%20that%20scO2%20is%20influenced%20by%20skin%20oxygen%20saturation%20because%20whole-body%20heating%20increased%20scO2%20by%203.6%25%20%282.1-5.1%25%3B%2095%25%20CI%29%20and%20skin%20oxygen%20saturation%20by%203.1%25%20%281.3-4.9%25%29%2C%20whereas%20scapO2%20remained%20unaffected.%20Conversely%2C%20hyperventilation%20decreased%20scO2%20by%202.1%25%20%280.4-3.7%25%29%20and%20scapO2%20by%205.3%25%20%283.8-6.9%25%29%2C%20whereas%20skin%20oxygen%20saturation%20increased%201.8%25%20%280.5-3.1%25%29.%20In%20response%20to%20hypoxia%2C%20scO2%20%2810.2%25%3B%206.6-13.7%25%29%2C%20scapO2%20%287.9%25%3B%206.4-9.4%25%29%2C%20and%20skin%20oxygen%20saturation%20%288.9%25%3B%206.3-11.6%25%29%20all%20decreased.%20With%20administration%20of%20norepinephrine%20there%20was%20a%202.2%25%20%281.0-4.3%25%29%20decrease%20in%20skin%20oxygen%20saturation%20and%20scO2%20decreased%206.2%25%20%284.2-8.0%25%29%2C%20with%20scapO2%20remaining%20unaffected.%5CnCONCLUSION%3A%20The%20results%20confirm%20that%20spatially%20resolved%20near-infrared%20spectroscopy%20detects%20cerebral%20deoxygenation%20with%20systemic%20hypoxic%20exposure%20and%20hyperventilation.%20However%2C%20a%20commonly%20used%20vasopressor%20norepinephrine%20disturbs%20skin%20oxygen%20saturation%20to%20an%20extent%20that%20influences%20scO2.%22%2C%22date%22%3A%22Aug%202012%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1097%5C%2FALN.0b013e3182605afe%22%2C%22ISSN%22%3A%221528-1175%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22MNXWSAUU%22%5D%2C%22dateModified%22%3A%222015-12-26T07%3A44%3A23Z%22%7D%7D%2C%7B%22key%22%3A%22RFE4KFHD%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Ogoh%20et%20al.%22%2C%22parsedDate%22%3A%222014-04%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%201.35%3B%20%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%20style%3D%5C%22clear%3A%20left%3B%20%5C%22%3E%5Cn%20%20%20%20%3Cdiv%20class%3D%5C%22csl-left-margin%5C%22%20style%3D%5C%22float%3A%20left%3B%20padding-right%3A%200.5em%3B%20text-align%3A%20right%3B%20width%3A%201em%3B%5C%22%3E1.%3C%5C%2Fdiv%3E%3Cdiv%20class%3D%5C%22csl-right-inline%5C%22%20style%3D%5C%22margin%3A%200%20.4em%200%201.5em%3B%5C%22%3EOgoh%20S%2C%20Sato%20K%2C%20Okazaki%20K%2C%20Miyamoto%20T%2C%20Secher%20F%2C%20S%26%23xF8%3Brensen%20H%2C%20et%20al.%20A%20decrease%20in%20spatially%20resolved%20near-infrared%20spectroscopy-determined%20frontal%20lobe%20tissue%20oxygenation%20by%20phenylephrine%20reflects%20reduced%20skin%20blood%20flow.%20Anesth%20Analg.%202014%20Apr%3B118%284%29%3A823%26%23x2013%3B9.%3C%5C%2Fdiv%3E%5Cn%20%20%20%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22A%20decrease%20in%20spatially%20resolved%20near-infrared%20spectroscopy-determined%20frontal%20lobe%20tissue%20oxygenation%20by%20phenylephrine%20reflects%20reduced%20skin%20blood%20flow%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Shigehiko%22%2C%22lastName%22%3A%22Ogoh%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Kohei%22%2C%22lastName%22%3A%22Sato%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Kazunobu%22%2C%22lastName%22%3A%22Okazaki%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Tadayoshi%22%2C%22lastName%22%3A%22Miyamoto%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Frederik%22%2C%22lastName%22%3A%22Secher%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Henrik%22%2C%22lastName%22%3A%22S%5Cu00f8rensen%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Peter%22%2C%22lastName%22%3A%22Rasmussen%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Niels%20H.%22%2C%22lastName%22%3A%22Secher%22%7D%5D%2C%22abstractNote%22%3A%22BACKGROUND%3A%20Spatially%20resolved%20near-infrared%20spectroscopy-determined%20frontal%20lobe%20tissue%20oxygenation%20%28ScO2%29%20is%20reduced%20with%20administration%20of%20phenylephrine%2C%20while%20cerebral%20blood%20flow%20may%20remain%20unaffected.%20We%20hypothesized%20that%20extracranial%20vasoconstriction%20explains%20the%20effect%20of%20phenylephrine%20on%20ScO2.%5CnMETHODS%3A%20We%20measured%20ScO2%20and%20internal%20and%20external%20carotid%20as%20well%20as%20vertebral%20artery%20blood%20flow%20in%207%20volunteers%20%2825%20%5BSD%204%5D%20years%29%20by%20duplex%20ultrasonography%20during%20IV%20infusion%20of%20phenylephrine%2C%20together%20with%20middle%20cerebral%20artery%20mean%20blood%20velocity%2C%20forehead%20skin%20blood%20flow%2C%20and%20mean%20arterial%20blood%20pressure.%5CnRESULTS%3A%20During%20phenylephrine%20infusion%2C%20mean%20arterial%20blood%20pressure%20increased%2C%20while%20ScO2%20decreased%20by%20-19%25%20%5Cu00b1%203%25%20%28mean%20%5Cu00b1%20SE%3B%20P%20%3D%200.0005%29.%20External%20carotid%20artery%20%28-27.5%25%20%5Cu00b1%203.0%25%29%20and%20skin%20blood%20flow%20%28-25.4%25%20%5Cu00b1%207.8%25%29%20decreased%20in%20response%20to%20phenylephrine%20administration%2C%20and%20there%20was%20a%20relationship%20between%20ScO2%20and%20forehead%20skin%20blood%20flow%20%28Pearson%20r%20%3D%200.55%2C%20P%20%3D%200.042%2C%2095%25%20confidence%20interval%20%5BCI%5D%2C%20%3D%200.025-0.84%3B%20Spearman%20r%20%3D%200.81%2C%20P%20%3C%200.001%2C%2095%25%20CI%2C%200.49-0.94%29%20and%20external%20carotid%20artery%20conductance%20%28Pearson%20r%20%3D%200.62%2C%20P%20%3D%200.019%2C%2095%25%20CI%2C%200.13%20to%200.86%3B%20Spearman%20r%20%3D%200.64%2C%20P%20%3D%200.012%2C%2095%25%20CI%2C%200.17-0.88%29.%5CnCONCLUSIONS%3A%20These%20findings%20suggest%20that%20a%20phenylephrine-induced%20decrease%20in%20ScO2%2C%20as%20determined%20by%20INVOS-4100%20near-infrared%20spectroscopy%2C%20reflects%20vasoconstriction%20in%20the%20extracranial%20vasculature%20rather%20than%20a%20decrease%20in%20cerebral%20oxygenation.%22%2C%22date%22%3A%22Apr%202014%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1213%5C%2FANE.0000000000000145%22%2C%22ISSN%22%3A%221526-7598%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22MNXWSAUU%22%5D%2C%22dateModified%22%3A%222015-12-26T07%3A37%3A56Z%22%7D%7D%2C%7B%22key%22%3A%22JW8WCQMG%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Day%20et%20al.%22%2C%22parsedDate%22%3A%222014-06%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%201.35%3B%20%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%20style%3D%5C%22clear%3A%20left%3B%20%5C%22%3E%5Cn%20%20%20%20%3Cdiv%20class%3D%5C%22csl-left-margin%5C%22%20style%3D%5C%22float%3A%20left%3B%20padding-right%3A%200.5em%3B%20text-align%3A%20right%3B%20width%3A%201em%3B%5C%22%3E1.%3C%5C%2Fdiv%3E%3Cdiv%20class%3D%5C%22csl-right-inline%5C%22%20style%3D%5C%22margin%3A%200%20.4em%200%201.5em%3B%5C%22%3EDay%20KM%2C%20Beckman%20RM%2C%20Machan%20JT%2C%20Morrissey%20PE.%20Efficacy%20and%20safety%20of%20phenylephrine%20in%20the%20management%20of%20low%20systolic%20blood%20pressure%20after%20renal%20transplantation.%20J%20Am%20Coll%20Surg.%202014%20Jun%3B218%286%29%3A1207%26%23x2013%3B13.%3C%5C%2Fdiv%3E%5Cn%20%20%20%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Efficacy%20and%20safety%20of%20phenylephrine%20in%20the%20management%20of%20low%20systolic%20blood%20pressure%20after%20renal%20transplantation%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Kristopher%20M.%22%2C%22lastName%22%3A%22Day%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Ross%20M.%22%2C%22lastName%22%3A%22Beckman%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Jason%20T.%22%2C%22lastName%22%3A%22Machan%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Paul%20E.%22%2C%22lastName%22%3A%22Morrissey%22%7D%5D%2C%22abstractNote%22%3A%22BACKGROUND%3A%20Phenylephrine%20can%20be%20used%20to%20treat%20postoperative%20hypotension%20after%20renal%20transplantation.%20However%2C%20its%20effect%20on%20the%20renal%20allograft%20is%20unknown.%20We%20evaluated%20the%20safety%20and%20efficacy%20of%20this%20approach.%5CnSTUDY%20DESIGN%3A%20A%20retrospective%20cohort%20study%20of%20307%20renal%20transplant%20recipients%20between%20November%202005%20and%20October%202011%20was%20conducted%2C%20including%2075%20who%20required%20phenylephrine%2C%2046%20of%20whom%20were%20deceased%20donors%20renal%20transplant%20%28DDRT%29%20recipients%20and%2029%20who%20were%20living%20donor%20transplant%20%28LDRT%29%20recipients.%20These%20were%20compared%20with%2075%20controls%20matched%20by%20sex%2C%20age%2C%20type%20of%20transplant%2C%20and%20etiology%20of%20renal%20failure.%20The%20primary%20outcome%20was%20rate%20of%20delayed%20graft%20function%20%28DGF%29.%20The%20following%20statistical%20tools%20were%20used%3A%20paired%20t-test%20for%20continuous%20data%2C%20McNemar%27s%20test%20for%20categorical%20data%2C%20and%20a%20nonlinear%20mixed%20decay%20model%20for%20change%20in%20serum%20creatinine%20%28Cr%29.%5CnRESULTS%3A%20Of%2046%20DDRT%20recipients%20who%20required%20phenylephrine%2C%2017%20developed%20DGF%20compared%20with%2010%20matched%20controls%20%28relative%20risk%20%5BRR%5D%202.9%2C%20CI%201.4%20to%206.0%2C%20p%5Cu00a0%3D%200.0040%29.%20Only%20one%20LDRT%20recipient%20required%20hemodialysis%20%28DGF%29.%20No%20differences%20were%20noted%20in%20the%20number%20of%20hemodialysis%20treatments%20required%20%28mean%202.7%20in%20treatment%20group%20vs%203.4%20in%20control%29.%20No%20significant%20differences%20were%20observed%20between%20phenylephrine%20and%20control%20groups%20in%20renal%20function%20on%20postoperative%20days%2030%2C%2090%2C%20and%20365%20Cr%20or%20graft%20survival.%20The%20immediate%20postoperative%20normalization%20of%20Cr%20was%20slower%20in%20the%20DDRT%20phenylephrine%20group%20compared%20with%20DDRT%20controls%20%28p%20%3C%200.0001%29%2C%20but%20no%20difference%20in%20Cr%20was%20noted%20before%20discharge%20%28p%5Cu00a0%3D%200.49%29.%5CnCONCLUSIONS%3A%20Although%20there%20is%20a%20brief%20association%20between%20phenylephrine%20administration%20and%20a%20slower%20rate%20of%20transplanted%20kidney%20recovery%2C%20there%20is%20no%20clinically%20or%20statistically%20significant%20impaired%20outcome%20in%20the%20phenylephrine%20group%20at%20time%20of%20discharge.%20Administration%20of%20phenylephrine%20to%20support%20low%20blood%20pressure%20after%20renal%20transplant%20appears%20safe.%22%2C%22date%22%3A%22Jun%202014%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1016%5C%2Fj.jamcollsurg.2014.01.058%22%2C%22ISSN%22%3A%221879-1190%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22MNXWSAUU%22%5D%2C%22dateModified%22%3A%222015-12-26T07%3A36%3A54Z%22%7D%7D%2C%7B%22key%22%3A%22A3PB88VH%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Samarendra%20and%20Mangione%22%2C%22parsedDate%22%3A%222015-01-27%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%201.35%3B%20%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%20style%3D%5C%22clear%3A%20left%3B%20%5C%22%3E%5Cn%20%20%20%20%3Cdiv%20class%3D%5C%22csl-left-margin%5C%22%20style%3D%5C%22float%3A%20left%3B%20padding-right%3A%200.5em%3B%20text-align%3A%20right%3B%20width%3A%201em%3B%5C%22%3E1.%3C%5C%2Fdiv%3E%3Cdiv%20class%3D%5C%22csl-right-inline%5C%22%20style%3D%5C%22margin%3A%200%20.4em%200%201.5em%3B%5C%22%3ESamarendra%20P%2C%20Mangione%20MP.%20Aortic%20stenosis%20and%20perioperative%20risk%20with%20noncardiac%20surgery.%20J%20Am%20Coll%20Cardiol.%202015%20Jan%2027%3B65%283%29%3A295%26%23x2013%3B302.%3C%5C%2Fdiv%3E%5Cn%20%20%20%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Aortic%20stenosis%20and%20perioperative%20risk%20with%20noncardiac%20surgery%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Padmaraj%22%2C%22lastName%22%3A%22Samarendra%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Michael%20P.%22%2C%22lastName%22%3A%22Mangione%22%7D%5D%2C%22abstractNote%22%3A%22Aortic%20stenosis%20%28AS%29%20is%20characterized%20as%20a%20high-risk%20index%20for%20cardiac%20complications%20during%20noncardiac%20surgery.%20The%20American%20College%20of%20Cardiology%5C%2FAmerican%20Heart%20Association%20guidelines%20define%20severe%20AS%20as%20aortic%20valve%20area%5Cu00a0%5Cu22641%20cm%282%29%2C%20mean%20gradient%20of%5Cu00a0%5Cu226540%20mm%5Cu00a0Hg%2C%20and%20peak%20velocity%20of%5Cu00a0%5Cu22654%20m%5C%2Fs.%20As%20per%20current%20clinical%20practice%2C%20any%20of%20these%20characteristic%20features%20label%20a%20patient%20as%20at%20high%20risk%20for%20noncardiac%20surgery.%20However%2C%20these%20parameters%20appear%20inconsistent%2C%20particularly%20with%20respect%20to%20the%20aortic%20valve%20area%20cutoff%20value.%20The%20perioperative%20risk%20associated%20with%20AS%20during%20noncardiac%20surgery%20depends%20upon%20its%20severity%20%28moderate%20vs.%20severe%29%2C%20clinical%20status%2C%20and%20the%20complexity%20of%20the%20surgical%20procedure%20%28low%5Cu00a0to%20intermediate%20risk%20vs.%20high%20risk%29.%20A%20critical%20analysis%20of%20old%20and%20new%20data%20from%20published%20studies%20indicates%20that%20the%20significance%20of%20the%5Cu00a0presence%20of%20AS%20in%20patients%20undergoing%20noncardiac%20surgery%20is%20overemphasized%20in%20studies%20that%20predate%20the%20more%20recent%20advances%20in%20echocardiography%20and%20cardiac%20catheterization%20in%20assessment%20of%20aortic%20stenosis%2C%20anesthetic%20and%20surgical%20techniques%2C%20as%20well%20as%20post-operative%20patient%20care.%22%2C%22date%22%3A%22Jan%2027%2C%202015%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1016%5C%2Fj.jacc.2014.10.051%22%2C%22ISSN%22%3A%221558-3597%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22MNXWSAUU%22%5D%2C%22dateModified%22%3A%222015-12-26T07%3A29%3A29Z%22%7D%7D%2C%7B%22key%22%3A%22K7PU8FVZ%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22D%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%201.35%3B%20%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%20style%3D%5C%22clear%3A%20left%3B%20%5C%22%3E%5Cn%20%20%20%20%3Cdiv%20class%3D%5C%22csl-left-margin%5C%22%20style%3D%5C%22float%3A%20left%3B%20padding-right%3A%200.5em%3B%20text-align%3A%20right%3B%20width%3A%201em%3B%5C%22%3E1.%3C%5C%2Fdiv%3E%3Cdiv%20class%3D%5C%22csl-right-inline%5C%22%20style%3D%5C%22margin%3A%200%20.4em%200%201.5em%3B%5C%22%3ED%20T.%20PERIPHERAL%20NORADRENALINE%20%5BInternet%5D.%20%5Bcited%202015%20Dec%2026%5D.%20Available%20from%3A%20%3Ca%20href%3D%27http%3A%5C%2F%5C%2Fwww.scancrit.com%5C%2F2015%5C%2F06%5C%2F10%5C%2Fperipheral-noradrenaline%5C%2F%27%3Ehttp%3A%5C%2F%5C%2Fwww.scancrit.com%5C%2F2015%5C%2F06%5C%2F10%5C%2Fperipheral-noradrenaline%5C%2F%3C%5C%2Fa%3E%3C%5C%2Fdiv%3E%5Cn%20%20%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22blogPost%22%2C%22title%22%3A%22PERIPHERAL%20NORADRENALINE%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Thomas%22%2C%22lastName%22%3A%22D%22%7D%5D%2C%22abstractNote%22%3A%22%22%2C%22blogTitle%22%3A%22%22%2C%22date%22%3A%22%22%2C%22url%22%3A%22http%3A%5C%2F%5C%2Fwww.scancrit.com%5C%2F2015%5C%2F06%5C%2F10%5C%2Fperipheral-noradrenaline%5C%2F%22%2C%22language%22%3A%22%22%2C%22collections%22%3A%5B%22MNXWSAUU%22%5D%2C%22dateModified%22%3A%222015-12-26T07%3A27%3A43Z%22%7D%7D%2C%7B%22key%22%3A%22BE55VRCU%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Carvalho%20and%20Dyer%22%2C%22parsedDate%22%3A%222015%22%2C%22numChildren%22%3A0%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%201.35%3B%20%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%20style%3D%5C%22clear%3A%20left%3B%20%5C%22%3E%5Cn%20%20%20%20%3Cdiv%20class%3D%5C%22csl-left-margin%5C%22%20style%3D%5C%22float%3A%20left%3B%20padding-right%3A%200.5em%3B%20text-align%3A%20right%3B%20width%3A%201em%3B%5C%22%3E1.%3C%5C%2Fdiv%3E%3Cdiv%20class%3D%5C%22csl-right-inline%5C%22%20style%3D%5C%22margin%3A%200%20.4em%200%201.5em%3B%5C%22%3ECarvalho%20B%2C%20Dyer%20RA.%20Norepinephrine%20for%20Spinal%20Hypotension%20during%20Cesarean%20Delivery%3A%20Another%20Paradigm%20Shift%3F%20Anesthesiology%20%5BInternet%5D.%202015%20%5Bcited%202015%20Dec%2026%5D%3B122%284%29%3A728%26%23x2013%3B30.%20Available%20from%3A%20%3Ca%20href%3D%27http%3A%5C%2F%5C%2Fcontent.wkhealth.com%5C%2Flinkback%5C%2Fopenurl%3Fsid%3DWKPTLP%3Alandingpage%26an%3D00000542-201504000-00009%27%3Ehttp%3A%5C%2F%5C%2Fcontent.wkhealth.com%5C%2Flinkback%5C%2Fopenurl%3Fsid%3DWKPTLP%3Alandingpage%26an%3D00000542-201504000-00009%3C%5C%2Fa%3E%3C%5C%2Fdiv%3E%5Cn%20%20%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Norepinephrine%20for%20Spinal%20Hypotension%20during%20Cesarean%20Delivery%3A%20Another%20Paradigm%20Shift%3F%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Brendan%22%2C%22lastName%22%3A%22Carvalho%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Robert%20A.%22%2C%22lastName%22%3A%22Dyer%22%7D%5D%2C%22abstractNote%22%3A%22%22%2C%22date%22%3A%2204%5C%2F2015%22%2C%22language%22%3A%22en%22%2C%22DOI%22%3A%2210.1097%5C%2FALN.0000000000000602%22%2C%22ISSN%22%3A%220003-3022%22%2C%22url%22%3A%22http%3A%5C%2F%5C%2Fcontent.wkhealth.com%5C%2Flinkback%5C%2Fopenurl%3Fsid%3DWKPTLP%3Alandingpage%26an%3D00000542-201504000-00009%22%2C%22collections%22%3A%5B%22MNXWSAUU%22%5D%2C%22dateModified%22%3A%222015-12-26T06%3A33%3A43Z%22%7D%7D%2C%7B%22key%22%3A%225HI72HGN%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Habib%22%2C%22parsedDate%22%3A%222012-02%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%201.35%3B%20%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%20style%3D%5C%22clear%3A%20left%3B%20%5C%22%3E%5Cn%20%20%20%20%3Cdiv%20class%3D%5C%22csl-left-margin%5C%22%20style%3D%5C%22float%3A%20left%3B%20padding-right%3A%200.5em%3B%20text-align%3A%20right%3B%20width%3A%201em%3B%5C%22%3E1.%3C%5C%2Fdiv%3E%3Cdiv%20class%3D%5C%22csl-right-inline%5C%22%20style%3D%5C%22margin%3A%200%20.4em%200%201.5em%3B%5C%22%3EHabib%20AS.%20A%20review%20of%20the%20impact%20of%20phenylephrine%20administration%20on%20maternal%20hemodynamics%20and%20maternal%20and%20neonatal%20outcomes%20in%20women%20undergoing%20cesarean%20delivery%20under%20spinal%20anesthesia.%20Anesth%20Analg.%202012%20Feb%3B114%282%29%3A377%26%23x2013%3B90.%3C%5C%2Fdiv%3E%5Cn%20%20%20%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22A%20review%20of%20the%20impact%20of%20phenylephrine%20administration%20on%20maternal%20hemodynamics%20and%20maternal%20and%20neonatal%20outcomes%20in%20women%20undergoing%20cesarean%20delivery%20under%20spinal%20anesthesia%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Ashraf%20S.%22%2C%22lastName%22%3A%22Habib%22%7D%5D%2C%22abstractNote%22%3A%22Phenylephrine%20is%20effective%20for%20the%20management%20of%20spinal%20anesthesia-induced%20hypotension%20in%20parturients%20undergoing%20cesarean%20delivery%20under%20spinal%20anesthesia.%20While%20ephedrine%20was%20previously%20considered%20the%20vasopressor%20of%20choice%20in%20obstetric%20patients%2C%20phenylephrine%20is%20increasingly%20being%20used.%20This%20is%20largely%20due%20to%20studies%20suggesting%20improved%20fetal%20acid-base%20status%20with%20the%20use%20of%20phenylephrine%20as%20well%20as%20the%20low%20incidence%20of%20hypotension%20and%20its%20related%20side%20effects%20with%20prophylactic%20phenylephrine%20regimens.%20This%20review%20highlights%20the%20effects%20of%20phenylephrine%20compared%20with%20ephedrine%20on%20maternal%20hemodynamics%20%28arterial%20blood%20pressure%2C%20heart%20rate%2C%20and%20cardiac%20output%29%2C%20and%20occurrence%20of%20intraoperative%20nausea%20and%20vomiting.%20The%20impact%20of%20the%20administration%20of%20phenylephrine%20as%20a%20bolus%20for%20the%20treatment%20of%20established%20hypotension%20compared%20with%20its%20administration%20as%20a%20prophylactic%20infusion%20is%20discussed.%20This%20article%20also%20reviews%20the%20impact%20of%20phenylephrine%20compared%20with%20ephedrine%20on%20uteroplacental%20perfusion%2C%20and%20fetal%20outcomes%20such%20as%20neonatal%20acid-base%20status%20and%20Apgar%20scores.%20The%20optimum%20dosing%20regimen%20for%20phenylephrine%20administration%20is%20also%20discussed.%22%2C%22date%22%3A%22Feb%202012%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1213%5C%2FANE.0b013e3182373a3e%22%2C%22ISSN%22%3A%221526-7598%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22MNXWSAUU%22%5D%2C%22dateModified%22%3A%222015-12-26T06%3A25%3A47Z%22%7D%7D%2C%7B%22key%22%3A%22R696WN28%22%2C%22library%22%3A%7B%22id%22%3A858234%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Ngan%20Kee%20et%20al.%22%2C%22parsedDate%22%3A%222015-04%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%3Cdiv%20class%3D%5C%22csl-bib-body%5C%22%20style%3D%5C%22line-height%3A%201.35%3B%20%5C%22%3E%5Cn%20%20%3Cdiv%20class%3D%5C%22csl-entry%5C%22%20style%3D%5C%22clear%3A%20left%3B%20%5C%22%3E%5Cn%20%20%20%20%3Cdiv%20class%3D%5C%22csl-left-margin%5C%22%20style%3D%5C%22float%3A%20left%3B%20padding-right%3A%200.5em%3B%20text-align%3A%20right%3B%20width%3A%201em%3B%5C%22%3E1.%3C%5C%2Fdiv%3E%3Cdiv%20class%3D%5C%22csl-right-inline%5C%22%20style%3D%5C%22margin%3A%200%20.4em%200%201.5em%3B%5C%22%3ENgan%20Kee%20WD%2C%20Lee%20SWY%2C%20Ng%20FF%2C%20Tan%20PE%2C%20Khaw%20KS.%20Randomized%20double-blinded%20comparison%20of%20norepinephrine%20and%20phenylephrine%20for%20maintenance%20of%20blood%20pressure%20during%20spinal%20anesthesia%20for%20cesarean%20delivery.%20Anesthesiology.%202015%20Apr%3B122%284%29%3A736%26%23x2013%3B45.%3C%5C%2Fdiv%3E%5Cn%20%20%20%3C%5C%2Fdiv%3E%5Cn%3C%5C%2Fdiv%3E%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Randomized%20double-blinded%20comparison%20of%20norepinephrine%20and%20phenylephrine%20for%20maintenance%20of%20blood%20pressure%20during%20spinal%20anesthesia%20for%20cesarean%20delivery%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Warwick%20D.%22%2C%22lastName%22%3A%22Ngan%20Kee%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Shara%20W.%20Y.%22%2C%22lastName%22%3A%22Lee%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Floria%20F.%22%2C%22lastName%22%3A%22Ng%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Perpetua%20E.%22%2C%22lastName%22%3A%22Tan%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Kim%20S.%22%2C%22lastName%22%3A%22Khaw%22%7D%5D%2C%22abstractNote%22%3A%22BACKGROUND%3A%20During%20spinal%20anesthesia%20for%20cesarean%20delivery%2C%20phenylephrine%20can%20cause%20reflexive%20decreases%20in%20maternal%20heart%20rate%20and%20cardiac%20output.%20Norepinephrine%20has%20weak%20%5Cu03b2-adrenergic%20receptor%20agonist%20activity%20in%20addition%20to%20potent%20%5Cu03b1-adrenergic%20receptor%20activity%20and%20therefore%20may%20be%20suitable%20for%20maintaining%20blood%20pressure%20with%20less%20negative%20effects%20on%20heart%20rate%20and%20cardiac%20output%20compared%20with%20phenylephrine.%5CnMETHODS%3A%20In%20a%20randomized%2C%20double-blinded%20study%2C%20104%20healthy%20patients%20having%20cesarean%20delivery%20under%20spinal%20anesthesia%20were%20randomized%20to%20have%20systolic%20blood%20pressure%20maintained%20with%20a%20computer-controlled%20infusion%20of%20norepinephrine%205%20%5Cu03bcg%5C%2Fml%20or%20phenylephrine%20100%20%5Cu03bcg%5C%2Fml.%20The%20primary%20outcome%20compared%20was%20cardiac%20output.%20Blood%20pressure%20heart%20rate%20and%20neonatal%20outcome%20were%20also%20compared.%5CnRESULTS%3A%20Normalized%20cardiac%20output%205%20min%20after%20induction%20was%20greater%20in%20the%20norepinephrine%20group%20versus%20the%20phenylephrine%20group%20%28median%20102.7%25%20%5Binterquartile%20range%2C%2094.3%20to%20116.7%25%5D%20versus%2093.8%25%20%5B85.0%20to%20103.1%25%5D%2C%20P%20%3D%200.004%2C%20median%20difference%209.8%25%2C%2095%25%20CI%20of%20difference%20between%20medians%202.8%20to%2016.1%25%29.%20From%20induction%20until%20uterine%20incision%2C%20for%20norepinephrine%20versus%20phenylephrine%2C%20systolic%20blood%20pressure%20and%20stroke%20volume%20were%20similar%2C%20heart%20rate%20and%20cardiac%20output%20were%20greater%2C%20systemic%20vascular%20resistance%20was%20lower%2C%20and%20the%20incidence%20of%20bradycardia%20was%20smaller.%20Neonatal%20outcome%20was%20similar%20between%20groups.%5CnCONCLUSIONS%3A%20When%20given%20by%20computer-controlled%20infusion%20during%20spinal%20anesthesia%20for%20cesarean%20delivery%2C%20norepinephrine%20was%20effective%20for%20maintaining%20blood%20pressure%20and%20was%20associated%20with%20greater%20heart%20rate%20and%20cardiac%20output%20compared%20with%20phenylephrine.%20Further%20work%20would%20be%20of%20interest%20to%20confirm%20the%20safety%20and%20efficacy%20of%20norepinephrine%20as%20a%20vasopressor%20in%20obstetric%20patients.%22%2C%22date%22%3A%22Apr%202015%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1097%5C%2FALN.0000000000000601%22%2C%22ISSN%22%3A%221528-1175%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22MNXWSAUU%22%5D%2C%22dateModified%22%3A%222015-12-26T06%3A23%3A32Z%22%7D%7D%5D%7D
1.
Goertz AW, Lindner KH, Seefelder C, Schirmer U, Beyer M, Georgieff M. Effect of phenylephrine bolus administration on global left ventricular function in patients with coronary artery disease and patients with valvular aortic stenosis. Anesthesiology. 1993 May;78(5):834–41.
1.
Meng L, Cannesson M, Alexander BS, Yu Z, Kain ZN, Cerussi AE, et al. Effect of phenylephrine and ephedrine bolus treatment on cerebral oxygenation in anaesthetized patients. Br J Anaesth. 2011 Aug;107(2):209–17.
1.
Meng L, Gelb AW, Alexander BS, Cerussi AE, Tromberg BJ, Yu Z, et al. Impact of phenylephrine administration on cerebral tissue oxygen saturation and blood volume is modulated by carbon dioxide in anaesthetized patients. Br J Anaesth. 2012 May;108(5):815–22.
1.
Thiele RH, Nemergut EC, Lynch C. The physiologic implications of isolated alpha(1) adrenergic stimulation. Anesth Analg. 2011 Aug;113(2):284–96.
1.
Thiele RH, Nemergut EC, Lynch C. The clinical implications of isolated alpha(1) adrenergic stimulation. Anesth Analg. 2011 Aug;113(2):297–304.
1.
Pathak D, Pennefather SH, Russell GN, Al Rawi O, Dave IC, Gilby S, et al. Phenylephrine infusion improves blood flow to the stomach during oesophagectomy in the presence of a thoracic epidural analgesia. Eur J Cardiothorac Surg. 2013 Jul;44(1):130–3.
1.
Ibrahim AMS, Kim PS, Rabie AN, Lee BT, Lin SJ. Vasopressors and reconstructive flap perfusion: a review of the literature comparing the effects of various pharmacologic agents. Ann Plast Surg. 2014 Aug;73(2):245–8.
1.
Sørensen H, Rasmussen P, Sato K, Persson S, Olesen ND, Nielsen HB, et al. External carotid artery flow maintains near infrared spectroscopy-determined frontal lobe oxygenation during ephedrine administration. Br J Anaesth. 2014 Sep;113(3):452–8.
1.
Atkinson HC, Stanescu I, Anderson BJ. Increased phenylephrine plasma levels with administration of acetaminophen. N Engl J Med. 2014 Mar 20;370(12):1171–2.
1.
Sørensen H, Secher NH, Siebenmann C, Nielsen HB, Kohl-Bareis M, Lundby C, et al. Cutaneous vasoconstriction affects near-infrared spectroscopy determined cerebral oxygen saturation during administration of norepinephrine. Anesthesiology. 2012 Aug;117(2):263–70.
1.
Ogoh S, Sato K, Okazaki K, Miyamoto T, Secher F, Sørensen H, et al. A decrease in spatially resolved near-infrared spectroscopy-determined frontal lobe tissue oxygenation by phenylephrine reflects reduced skin blood flow. Anesth Analg. 2014 Apr;118(4):823–9.
1.
Day KM, Beckman RM, Machan JT, Morrissey PE. Efficacy and safety of phenylephrine in the management of low systolic blood pressure after renal transplantation. J Am Coll Surg. 2014 Jun;218(6):1207–13.
1.
Samarendra P, Mangione MP. Aortic stenosis and perioperative risk with noncardiac surgery. J Am Coll Cardiol. 2015 Jan 27;65(3):295–302.
1.
Habib AS. A review of the impact of phenylephrine administration on maternal hemodynamics and maternal and neonatal outcomes in women undergoing cesarean delivery under spinal anesthesia. Anesth Analg. 2012 Feb;114(2):377–90.
1.
Ngan Kee WD, Lee SWY, Ng FF, Tan PE, Khaw KS. Randomized double-blinded comparison of norepinephrine and phenylephrine for maintenance of blood pressure during spinal anesthesia for cesarean delivery. Anesthesiology. 2015 Apr;122(4):736–45.

20 réponses sur « je n’aime pas la Néosynéphrine, mais… #inception »
[…] si je pense que la vasoplégie est le noeud du problème, j’administre de la noradrénaline, je n’utilise pas de phenylephrine […]
La remarque la plus rapide : comment le BJA a-t-il pu laisser passer cet article ?
La remarque à lire hors phase post-prandiale :
– Le sang circule du point à haute pression (l’aorte) vers un zone à basse pression (le lit capillaire)
– Entre la zone à haute pression et la zone à basse pression, la pression décroit. La pression humérale est forcément inférieur à la pression aortique (sinon le sang ne coulerait pas).
– La pression aortique est égale à DC x Rtotale.
– Dans le cas de résistances en parallèle, 1/Rtot = 1/R1 + 1/R2 + 1/R3 + …
– Si R2 est très basse, 1/R2 est très élevé, donc quelques soient les autres résistances, 1/Rtot est très élevé. D’où Rtot est très basse (il suffit d’un point du circuit où les résistances sont très basses pour que tout le système devienne à basse résistance).
– Si Rtot est basse et DC peu modifié alors PAo est basse.
– Et comme PA humérale < PAo, elle est basse aussi.
j’ai zappé le deuxième cours d’électricité mais j’ai vraiment bien fait de poser ma question con 😀
pleins de méta lectures sur la Néo finalement :
1) la néo c’est bof
2) la littérature est toujours à creuser
3) bloguer+Twitter c’est vraiment incroyable
4) poser une question con c’est toujours instructif 🙂
P.S. pour le BJA, je crois qu’au bout d’un moment, il devient plus intéressant de lire des papiers fondamentaux obscurs comme ça http://high-fat-nutrition.blogspot.fr/2015/12/acetoacetate-and-arterial-oxygen-tension.html plutôt que des grosses publis des grosses revues, on échappe ainsi à certains pièges (copinage ?)
P.P.S. surtout la NIRS est-ce bien sérieux ?
La NIRS cérébrale chez l’adulte, maintenant je crois que tout le monde reconnaît que ça mesure surtout de la NIRS du muscle frontal et assez peu quoique ce soit dans le cerveau.
PHRC en cours sur NIRS et chirurgie carotidienne, résultats probablement au prochain congrèsSFAR…
Question hors sujet et sur un détail : pourquoi mettez-vous un tréma à Doppler ?
Les références sérieuses qu’on trouve sur l’effet Doppler et sur Christian Doppler n’indiquent pas de tréma.
Et pourtant, on trouve assez fréquemment l’orthographe avec ‹ö›. Avez-vous une source ?
j’écris döppler juste pour faire sourire Philippe du blog Echocardioblog #PJ 😉 mais en vrai vous soulevez un vrai lièvre 🙂 d’où vient cette passion pour le umlaut ?! je suis sûr que vous avez une piste non ?
Non, c’est une vrai question.
J’ai l’impression qu’il y a une trentaine d’années, l’umlaut était plus répandu (pour faire plus allemand ?), puis qu’internet et l’accès plus direct aux sources l’a fait diminuer.
Sauf peut-être dans le domaine médical. N’aurait pas une marque déposée ou de la pub qui répand cette graphie?
C’est parce que le son du flux rappelle du Death Metal
Merci pour ce billet, j’imagine que notre petite discussion de l’autre jour sur la neo fait partie entre autre du moteur de cette rédaction, celui-ci confirme avec certes quelques nuances que je n’avais pas (je n’avais gardé en tête que de mauvais à priori sur la neo) que même s’il est bon de se remettre en question, je ne comprends pas ce qui justifie pour l’instant de choisir systématiquement la neo pour la totalité de ses supports aminergiques sur patients critiques à la place de la noradré dans certains centres, c’est une démarche qui découle à la base d’habitudes de SSPI sur certains patients, qui ont ensuite coulé sur les habitudes de déchocage, dans des situations où la noradré est plus étudiée pourtant.
En tout cas ton billet va me forcer à réfléchir un peu plus sur ce produit, pour le considérer peut-être de « nettement moins approprié » à « peut-être au moins équivalent? » à ses produits cousins, en insistant sur le peut-être. Et encore faut-il savoir selon quel type de mesure…
voilà, la néo c’est pas forcément le diable, mais il y a plus de littérature pour un bénéfice avec la noradrénaline. En tout cas, pour la situation de neurochir que tu m’as décrite, la néo n’a pas sa place pour moi.
En tout cas, sa disparition à court terme de la pharmacie de notre CHU est envisagée.
J’ai du mal à considérer qu’on puisse trouver des avantages à la néo par rapport à la noradrénaline. Son essor est dû :
– à sa popularité pour la césarienne. Je ne connais pas bien la littérature sur ce sujet, mais il parait logique que le foetus stimulé avec un B+ (éphédrine) augmente sa production de lactate non anaérobie et donc sorte à un pH plus acide sans que ça soit perfusionnel. Une popularité galvaudée ?
– à son utilisation sur VVP car le Vidal n’interdit pas de la mettre sur une VVP contrairement à la noradrénaline. C’est complètement con, soit les deux sont autorisées, soit les deux sont interdits (et je suis d’accord avec @nfkb, si on prend ses précautions on peut tout à fait faire de la NAD sur un VVP, je fais même des bolus de 5 à 15 µg IVD).
Après avoir lu les deux revues (physio et clinique) d’anesth analg) de 2011, mon jugement est devenu sans appel, c’est un médicament dangereux et inutile. Bravo à ta pharmacie !
Et pourtant il y a des personnes qui veulent mettre des béta bloquants avec de la noradré aux chocs septiques 🙂
Je pense qu’il n’y a pas de bon ou de mauvais médicament, il faut choisir le bon au bon moment. Pour la rachi ça ne me parait pas idiot, vu qu’on inhibe de manière sélective le tonus vasomoteur, on le rétablit de manière ciblée pour retrouver l’état physiologique.
Sinon dans le cas général je plussoie les bolus de noradrénaline.
Mais est-ce vraiment pour des raisons hémodynamiques ?
Et, sont-ce les mêmes qui veulent leur mettre des inotropes positifs ?
Merci pour ce billet instructif.
1) Réflexion intéressante sur la NIRS : je l’utilise souvent en chir cardiaque mais je me pose toujours cette même question: que mesure-t-on réellement? la vascularisation cutanée ou la vascularisation cérébrale?
2) Dans cette étude on remarque surtout que la phényléphrine fait chuter le DC (logique me direz-vous, c’est un alpha1-agoniste pur). Rien que pour ça, je me garde de trop l’utiliser. Je préfère tenter d’utiliser > 30mg d’éphédrine au total que recourir à des bolus de néosynéphrine.
3) je trouve que pharmacologiquement et physiologiquement, il est plus censé d’utiliser la noradrénaline en IVSE que la néo en bolus, car
– la noradré à une faible dose a un effet beta+ prédominant
– on peut parfaitement la mettre sur une VVP sans aucun problème (à des posologies raisonnables et sur une voie dédiée)
– c’est plus logique d’utiliser un médicament en continu qu’en bolus = quand on fait des bolus de néo, la PA fait le yoyo, tantôt on est à 150/90 puis on redescend à 70/40…. ce qui fait des variations importante de DC et de perfusion tissulaire, pas forcément bénéfiques (selon moi). Il est plus logique de pourvoir adapter un médicament maniable sur une administration en continu (même réflexion qu’AIVOC rémifentanil VS bolus de sufenta) avec de la noradré à 0,01 microgr/kg/min qui reste très maniable.
4) après il faut savoir réfléchir en fonction du contexte. En effet après une rachianesthésie il faut un alpha1-agoniste. L’hypotension artérielle post-induction est principalement liée à une vasoplégie etc… par contre en cas de perte liquidienne importante ou de saignement, il faut aussi avoir recours à un beta+ (d’ou le double bénéfice de la noradré).
J’adorerais que tu nous fasses un billet sur la NIRS et/ou la SvjO2
-l’étude citée concernant le nirs éphédrine vs phényléphrine est inintéressante mais repose sur un total de 33 patients, bien trop peu pour être vraiment significative à mes yeux. il faudrait d’autres études corroborant les conclusions sur un panel plus important de patients.
-la critique du nirs est interressante
bien d’accord… d’où les propos de Cayetanensis et la dérive de notre discussion sur la NIRS…
Concernant le NIRS, je suis majoritairement en chirurgie cardiaque, et de mon expérience y’a pas à dire, le NIRS fonctionne !
A la moindre hypotension, hypoxie, moindre événement délétère sous CEC le NIRS chute directement. Je trouve une excellente corrélation entre les différents événements et la. Variation du NIRS..