Cet article a été déplacé sur mon blog substack (1) L’allergie à la pénicilline – by nfkb – hic & nunc (substack.com)
Catégorie : ar101
Billets conseillés pour un(e) jeune interne d’anesthésie-réanimation
Lors d’une garde récente, j’ai eu une discussion très intéressante avec mon collègue adoré G. La conversation portait sur l’utilisation de la noradrénaline diluée, les pour, les contres, etc. Mes commentaires a posteriori du billet original restent valables mais je tiens quand même à en reparler parce que je pense que le sujet est très important.
Depuis la publication fin 2017 du billet sur la noradrénaline diluée en anesthésie, j’en ai vraiment beaucoup fait. Avec un peu plus de recul, je peux vous apporter un peu plus d’éléments pratiques. je rappelle qu’en anesthésie-réanimation on parle souvent de « gammas » pour parler de microgrammes (µg)
J’ai eu la chance d’être formé dans des services qui ont une longue histoire de soins de patients avec des pathologies oesophagiennes et gastriques. J’ai lu avec attention le RETEX d’inhalation pour une FOGD dans la newsletter #10 de l’Anesthesia safety Network. Les patients qui ont une achalasie de l’oesophage sont probablement parmi les plus à risque d’inhalation. Il y a d’autres situations similaires comme les patients ayant eu une oesophagectomie avec gastroplastie intrathoracique, le patient souffrant d’une occlusion intestinale aigüe haute ou encore d’une épistaxis avec beaucoup de sang ingéré. Bref, vous connaissez les situations.
Avec l’expérience, nous avons mis en place des stratégies complémentaires pour limiter le risque d’inhalation. Je vous propose d’y réfléchir en équipe chez vous :
- Regarder l’imagerie ou en parler avec le chirurgien quant à une éventuelle dilatation gastrique ou intestinale (corollaire : se former à l’échographie pour évaluer le pylore)
- erythromycine, 250 mg IV en prémédication
- SNG en aspiration à – 20 cmH20 avant d’arriver au bloc (attention à la distance à la narine si achalasie ou gastroplastie, plutôt 40 cm que les 60 cm habituels)
- distribuer des rôles si régurgitation, nommer la personne qui bascule la table d’opération
- induction plus profonde que d’habitude avec anticipation de la dégradation hémodynamique en utilisant un vasopresseur dès l’induction. J’utilise personnellement de la noradrénaline très diluée (16 gammas/ml) entre 20 et 40 ml/h (0,3 à 0,6 mg/h) pendant l’induction
- certains évoquent l’idée d’intuber en premier dans l’oesophage avec une grosse sonde pour diriger le vomissement à l’extérieur de la bouche du patient, à discuter
- canule d’aspiration chirurgicale (type Yankauer) en aspiration dans l’oropharynx dès la laryngoscopie, à coincer sur le côté gauche du laryngoscope
Ce même billet a été publié dans la newsletter #11 de l’ASN. Lisez les et soutenez le travail du Dr Frédéric Martin, ça vaut la peine.
Alexis, interne d’anesthésie, m’a contacté pour faire une note sur l’anesthésie sans morphiniques. Je lui cède la parole :
Vous avez dit 0 opioïde ?!
Bonjour, je m’appelle Minh, et suis anesthésiste-réanimateur.
Rémi m’a invité ici pour discuter de la noradrénaline en anesthésie.
Les agents anesthésiques couramment utilisés induisent une sympatholyse, une diminution de la noradrénaline et de l’adrénaline endogènes, résultant en une veinodilatation responsable d’une baisse de la précharge, et donc du débit cardiaque. Sur nos moniteurs, nous voyons souvent une hypotension artérielle apparaître, reflet de cette baisse du débit cardiaque.
Plusieurs solutions s’offrent à nous pour restaurer ce débit cardiaque.
Nous pouvons remplir le contenu veineux. Le contenant étant plus volumineux, la restauration de la précharge sera longue par cette méthode. Il y aura donc un temps d’hypodébit cardiaque et donc d’hypoperfusion d’organe assez long.
Le bon sens nous dirait : nous avons veinodilaté, il nous suffit donc de veinoconstricter.
Veinoconstrictons. Et nous avons des produits pour ça : éphédrine (E), néosynéphrine (N), noradrénaline (NA).
L’E agit par un mécanisme majoritairement indirect, en libérant les cathécholamines endogènes au niveau des terminaisons nerveuses. Elle augmente donc la noradrénaline endogène, favorisant la veinoconstriction et l’augmentation du débit cardiaque. Par ailleurs, elle induit une tachycardie.
En pratique, elle fonctionne, mais son efficacité est aléatoire, et épuisable.
Chez un patient que l’on ne veut pas rendre tachycarde, elle peut être délétère.
La N, de part son activité alpha1, a une activité purement vasoconstrictrice : veinoconstrictrice et artérioconstrictrice. Après administration de N, la pression artérielle remonte. Nous sommes contents. Cependant, le débit cardiaque diminue. Rappelons que PA = Q * RVS, ou PA est la pression artérielle, Q le débit cardiaque, RVS les résistances vasculaires systémiques. N augmente les RVS, mais diminue le Q, car augmente la postcharge. Le ventricule gauche (VG) doit lutter contre une postcharge plus importante, et chez les patients aux antécédents de dysfonction VG, la N peut suraltérer la fonction VG.
La NA est un vasoconstricteur. Veinoconstricteur en grande partie, et aussi un peu artérioconstricteur. Une administration de NA entraine une augmentation de la précharge, très peu de la postcharge, et en résulte une augmentation du débit cardiaque. C’est exactement ce que nous cherchons à faire. Nous savons que les agents anesthésiques couramment utilisés induisent une sympatholyse, une diminution de la noradrénaline et de l’adrénaline endogènes, résultant en une veinodilatation responsable d’une baisse de la précharge, et donc du débit cardiaque. La NA semble être la drogue de choix.
Alors pourquoi ne l’utilisons-nous pas ? Juste personnellement, je pense qu’une non utilisation de la NA ne peut relever que d’une méconnaissance de ce médicament. J’ai souvent entendu :
“Ca fait trop de vasoconstriction, il va faire un infartcus” -> Si on dit “trop”, c’est qu’il y a un effet dose. Il faut donc diminuer les doses. Et la NA n’est pas plus artérioconstrictrice que la N.
“J’ai déjà vu des gens amputés des 4 membres car trop de NA” -> C’était probablement des chocs septiques, avec une coagulopathie septique, des microthrombi, une défaillance endothéliale, nécéssitant des fortes doses de NA pour survivre. Certes, il y a eu une nécrose des extrémités, mais réfléchissons : imaginons que cette nécrose serait dûe à la NA. Imputabilité de la NA ? Arrêtons donc la NA. Les extrémités ne deviendraient pas roses, ce serait même plutôt tout l’organisme qui serait nécrosé.
« Moi j’ai toujours fait de la néo, ça a toujours marché » -> Effectivement si la finalité est la pression artérielle (mesurée dans les gros troncs artériels), la néo marche. Mais aujourd’hui, où notre finalité est le débit cardiaque, ben ça ne marche plus…
On administre du blanc, on diminue le débit cardiaque, on hypoperfuse les organes. On trouve ça normal.
Pourquoi ne pas antagoniser notre iatrogénie ?
C’est comme si je renversais du café dans la salle de pause, et que je disais “ça va sècher” ou “l’ASH va le faire”. Vous trouvez ça normal ?
Et du coup, la NA, c’est bien, mais est-ce qu’on a du recul là-dessus ?
La réponse est oui.
Une étude randomisée comparant la N et la NA chez des patientes bénéficiant d’une césarienne sous rachianesthésie publiée dans Anesthesiology en 2015 retrouvait : meilleur débit cardiaque dans le groupe NA, pas de différence de l’Apgar, meilleur pH néonatal dans le groupe NA, et, étonnamment, les dosages de noradrénaline et d’adrénaline dans l’artère et la veine ombilicales revenaient plus hauts dans le groupe N que dans le groupe NA. Adaptation foetale à l’hypoperfusion utéroplacentaire ?.
D’autres travaux comparant N et NA retrouvent une diminution du débit cardiaque dans le groupe N (voir table ci-dessous, extraite d’un article en accès libre).
En pratique : voici une recette que je trouve facile et efficace :
Une ampoule de NA (8mg) dans NaCl 0,9% ou SG5% 500mL = 16µg/mL.
A l’induction, tout de suite après avoir poussé l’agent hypodynamisant : 8µg (0,5mL) à 32µg (2mL) en bolus selon fragilité prévisible du patient.
Si nécessité de répéter les boli : seringue autopulsée, environ 30mL/h, à adapter selon la cinétique du débit cardiaque ou de la pression artérielle.
Une fois après avoir essayé, on ne peut plus s’en passer.
En plus, c’est tout doux.
Ca marche au bloc, mais c’est aussi une aide précieuse en réa ou dans les étages quand on est amené à intuber dans l’urgence.
En conclusion :
L’induction anesthésique s’accompagne le plus souvent d’une diminution du débit cardiaque, dont les mécanismes font intervenir une sympatholyse, une diminution de la noradrénaline et de l’adrénaline endogènes, résultant en une veinodilatation responsable d’une baisse de la précharge, et donc du débit cardiaque.
La noradrénaline antagonise ces mêmes mécanismes et restaure efficacement le débit cardiaque.
Pour une lecture plus approfondie, je vous propose:
Mets B. Should Norepinephrine, Rather than Phenylephrine, Be Considered the Primary Vasopressor in Anesthetic Practice? Anesth Analg 2016 May;122(5):1707-14.
Merci de votre attention.
Minh
(Je peux mettre à jour le billet de recette face à une hypotension ?!)
UPDATE : Beau travail du Pr FUTIER http://jamanetwork.com/journals/jama/fullarticle/2654895
UPDATE par Rémi/nfkb :
L’utilisation de la noradrénaline plus précocement est intéressante comme le montre Minh içi et notre pratique tant à le prouver. Néanmoins, ce médicament très puissant reste à manier dans des environnements adaptés et penser à switcher vite vers des concentrations plus élevées et à monitorer la pression artérielle de façon invasive dès que le patient devient instable et pas juste un peu vasoplégique à cause des drogues d’anesthésie. Merci Grégoire.
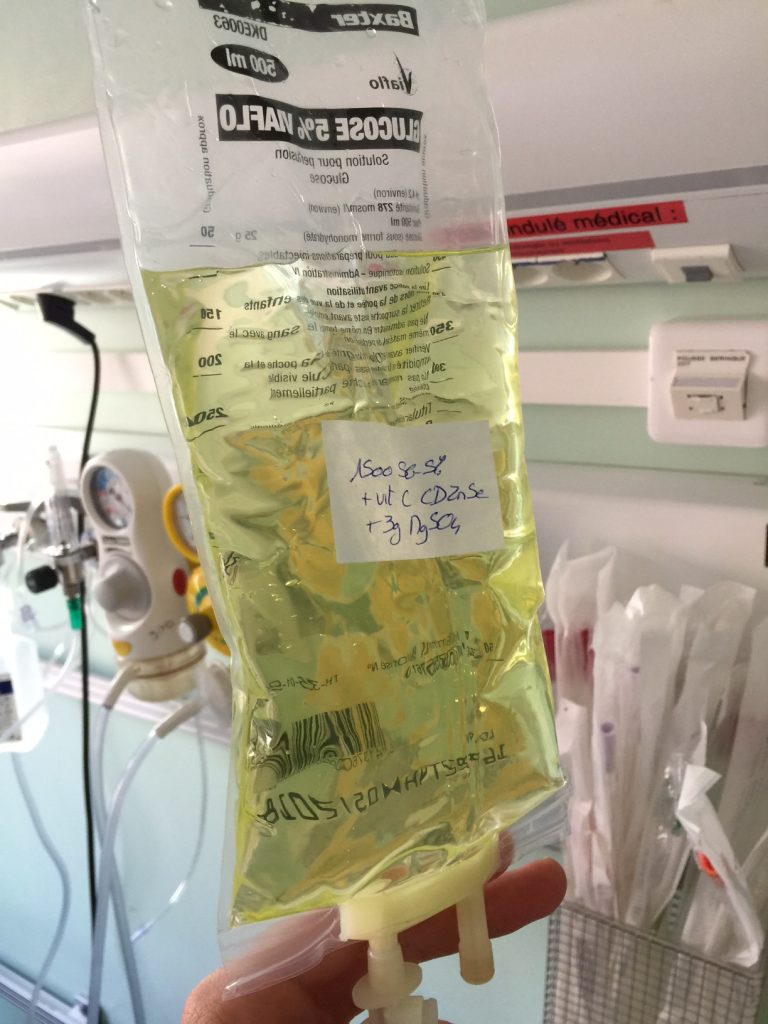
Update #2 Au quotidien, nous avons protocolé son utilisation dans le service avec une dilution dans une poche (Baxter Mono-luer) qui ne se percute pour éviter l’erreur d’administrer la poche en débit libre à un patient (merci Benjamin).
Cette poche reste dans un endroit précis. De plus, j’ai plutôt tendance à faire de plus en plus de SAP. Les boli je les limite à 16 µg, quitte à les répéter (après un résultat de PNI) en attendant l’introduction de la SAP. Je me focalise sur les patients les plus âgés ou fragiles. La noradrénaline en bolus à un patient jeune, ASA 1, vierge de médicaments au long cours (anti-HTA, antidépresseurs, etc) me parait plus sujette à des réactions importantes. Autour de 30/40 ml/h, il faut réfléchir à la situation et il parait logique de préparer de la noradrénaline plus concentrée en SAP.
Au fil de discussions, d’explications auprès des (e)IADE et des internes, j’ai eu envie de réécrire une note sur ce sujet. Ce billet est un article descriptif. J’aime bien cet exercice car il me permet de comparer dans le temps mes pratiques. La dernière fois que j’avais écrit sur ce sujet, je pense que j’étais beaucoup plus orienté « pharmaco » & co (ahah).
L’induction anesthésique est un moment clé. Je pense qu’il faut se l’approprier, le temps d’échange avec le patient est assez court et le contexte est stressant, c’est donc d’autant plus important d’être focalisé sur le patient. Vous pouvez avoir l’impression que des gens attendent autour de vous mais rappelez vous qu’ils ont besoin que vous ayez fini votre induction pour œuvrer. Vous ne vous ferez donc pas bousculé ! Prenez votre temps. La précipitation se ressent et elle est source d’erreur.
Je pense aussi que nous avons, nous, chefs d’orchestre de l’anesthésie-réanimation, un rôle d’exemplarité à avoir. Ça peut paraître pompeux, mais j’assume. Alors si notre comportement ne ressemble pas à celui d’un chef, je pense qu’il faut travailler à rectifier le tir.
Je viens de lire cette note chez le brillant Litthérateute. Cela m’a donné envie de vous parler de ma façon d’aborder la douleur aiguë. Je suis médecin anesthésiste, la gestion de la douleur aiguë c’est vraiment une part importante de mon métier. Dans l’exercice de ce billet de blog, je me suis concentré sur ce que j’écris, dans le dialogue je ne suis pas une machine, néanmoins, j’insiste quant à l’importance du choix des mots +++
Je travaille dans un service qui fait beaucoup de carcinologie en ORL. De fait, je m’occupe souvent de patients qui consomment beaucoup d’alcool régulièrement. Ainsi, lors d’une hospitalisation courte pour des examens complémentaires ou autour d’une opération, ces patients sont à risque de faire des symptômes liés au sevrage alcoolique.
Tout le monde connait le tryptique hydratation-benzo-vitaminothérapie. C’est plus qu’un réflexe ou un tiroir de réponse d’examen, j’ai presque l’impression que c’est un meme car ce truc s’écrit partout et qu’on ne sait plus trop démêler l’attitude rationnelle de l’habitude.
La ventilation spontanée normale
En ventilation spontanée, lorsque nous inspirons, nous créons une petite dépression dans notre thorax qui attire l’air de l’extérieur vers nos poumons. L’expiration est neurologiquement l’inhibition de l’inspiration. L’effort inspiratoire s’arrête et le thorax et ses poumons se rétractent “passivement” via les forces élastiques du système. À la fin de l’expiration, la pression dans les voies aériennes est nulle. À cet instant très précis, la pression dans les voies aériennes est égale à la pression atmosphérique, il n’y a pas de flux d’air entre l’extérieur et les poumons. À ce moment, le volume dans les poumons est appelé la capacité résiduelle fonctionnelle (CRF)
La PEP
La PEP est une pression positive (résiduelle) à la fin de l’expiration dans les voies aériennes du patient.
Dans la majorité des cas, on emploie le terme PEP en signifiant une pression appliquée par une machine sur les voies aériennes du patient. Le patient peut-être réveillé et en ventilation spontanée avec un masque appliqué sur ses voies aériennes ou carrément sédaté, curarisé, placé sous ventilation mécanique via une intubation trachéale.
Lorsqu’une PEP est appliquée au patient, sa CRF est augmentée car des alvéoles restent remplies du fait de l’existence d’une pression s’opposant à leur vidange. Ce volume résiduel est utile pour conserver les alvéoles au-dessus de ce qu’on appelle le volume de fermeture. Le volume de fermeture est le volume critique en deça duquel, l’alvéole se collabe. Lorsque de nombreuses alvéoles se collabent, il y a formation d’atélectasies. Il existe alors des zones de poumons qui ne sont plus ventilées alors qu’elles restent perfusées, créant ainsi du shunt.
La PEP vise à éviter le collapsus alvéolaire et ne sert pas “à réouvrir” des alvéoles collabées.
Voici mes habitudes pour gérer une chute de la pression artérielle lors d’une anesthésie générale sans contexte particulier.
Première chose : la chute de la pression artérielle lors d’une anesthésie générale ça s’anticipe. Pour moi quatre facteurs contribuent à maintenir la pression artérielle :
Deux discussions coup sur coup sur le même sujet, c’est une invitation à écrire un billet de blog. Mon laïus était prêt à se dérouler dans ma tête : je ne fais pas d’obstétrique, j’ai lu un article qui suggérait une baisse de l’oxygénation cérébrale, micro vs macrocirculation, la néo c’est de la merde, bla-bla-bla.
Et puis, au hasard d’un moment de glandouille, j’ai lancé un pubmed sur la phenylephrine (dci de Néosynéphrine) et j’ai commencé à me poser des questions. J’ai véritablement découvert quelques trucs qui changent ma vision des choses. Ainsi, je peux vous faire la double conclusion dans l’intro : bloguer m’a obligé à remettre en question mes dogmes et la littérature sur ce sujet est une bonne illustration que camper sur ses positions, c’est un peu con.
Je travaille dans un service qui fait beaucoup d’endoscopies ORL et de chirurgie endolaryngée. J’aimerais partager avec vous ce que mes collègues m’ont appris sur l’anesthésie de ce type de chirurgie.
Je ne comprends pas la mode de la plicature de la sonde d’intubation.
Les sondes d’intubation sortent fonctionnelles de l’usine et je ne vois pas en quoi on arriverait mieux à intuber en pliant la sonde au milieu. Je pense même que c’est le contraire.
Je me souviens bien d’une de mes premières visites pré-anesthésiques en premier semestre. Il s’agissait d’un patient au système cardio-vasculaire abîmé par le temps, la cigarette et un régime chti Deluxe. Peu habitué aux soins médicaux il n’avait pas de traitement. Les publications sur les béta-bloquants en périopératoire fleurissaient à l’époque et je me trouvais malin de réfléchir à une prescription d’un bétabloquant la veille de son intervention orthopédique… aujourd’hui je ne me pose plus ce genre de question, j’ai en effet un peu tendance à me méfier des béta-bloquants en périopératoire.
Le potassium c’est dangereux, c’est un des premiers trucs qu’on apprend en médecine : il ne fait pas bon avoir 7 mmol/l de potassium dans le sang et il faut être très vigilant lors des prescriptions de supplémentation intraveineuse. Une kaliémie (très) élevée tue.

Cependant je préfère voir le potassium à 4,5 qu’à 3,5 mmol/l sur le ionogramme de mes patients, surtout en contexte post-opératoire. Il y a beaucoup de raisons qui concourent à trouver une hypokaliémie en post-opératoire : dénutrition, diminution des apports oraux, aspiration gastrique, diurétiques, nutrition parentérale, insuline. La renutrition trop rapide peut même aboutir à une hypokaliémie et une hypophosphorémie profonde avec des conséquences dramatiques. Il faut donc être particulièrement méfiant chez les grands dénutris, anticiper et surveiller.
Le potassium est le principal cation intracellulaire. Il est indispensable au maintient de la polarisation cellulaire et le travail de la Na/K ATPase représente probablement à l’échelle de l’organisme une proportion énorme de notre dépense énergétique de repos. Inutile de vous rappeler que le respect de ce gradient électrochimique est utile pour échapper à des tas de dysfonctionnements cardio-vasculaires ou neurologiques. Le potassium est également un cofacteur de la pyruvate kinase, enzyme plutôt utile.
Revenons à nos moutons : la kaliémie « normale-haute ». Pour ça j’essaye d’anticiper les apports chez les patients opérés, j’utilise préférentiellement le Ringer Lactate pendant les blocs, je veille à apporter régulièrement un peu de magnésium et je supplémente volontiers en phosphate dipotassique (contexte d’hypokaliémie/hypophosphorémie) ou en chlorure de potassium (en me souvenant de la chlorémie du patient). Il faut bien se souvenir que le pool potassique de l’organisme est énorme. Ainsi je pense qu’en dehors d’une fonction rénale précaire il est plus efficace d’apporter franchement le potassium (sur l’intervalle correct pour être safe bien sûr). Je retiens qu’il faut approximativement 200 mmol de potassium pour élever la kaliémie de 1 mmol/l chez un patient franchement carencé (attention aux contexte de transfert intracellulaire). 200 mmol d’ion K+ se trouve dans 15g de KCl
Par contre dès que la voie per os est utilisable, hop, potassium par la bouche, plus sécu et tout aussi utile ! De plus la physiologie est bien faite, si l’intestin et le rein sont fonctionnels ils ne se laisseront pas déborder par des apports élevés en potassium per os.
Je chasse donc activement les hypokaliémies qui favoriseraient la constipation, l’arythmie ou la faiblesse musculaire.
Je pense vraiment que la physiologie aime le potassium. Il y a beaucoup de travaux qui s’intéressent au déséquilibre entre les apports sodés et potassiques dans la genèse des pathologies cardio-vasculaires comme l’hypertension. Une alimentation riche en potassium (fruits et légumes) est régulièrement associée à des bénéfices sanitaires dans les études épidémiologiques.
D’autres sujets connexes sont passionnants comme l’utilité du mélange glucose-insuline-potassium (GIK) dans l’ischémie myocardique et les nouvelles pistes du rôle des pompes Na/K dans la régulation du cycle cellulaire. Mais c’est un tout autre sujet…
La fibrillation auriculaire est fréquente après une chirurgie lourde, surtout s’il y a un abord thoracique. En chirurgie thoracique mon pifomètre me dit qu’il y a près de un patient sur trois qui fait un épisode de fibrillation auriculaire (FA).
Pour moi la FA est un signe d’alerte. J’évite de dégainer de l’amiodarone et de passer à autre chose. Je pense qu’il faut creuser un peu l’affaire. Je vous propose avec cette courte note ma « check-list passage en FA en post-opératoire ».
Le frisson post-opératoire est un phénomène curieux. Il peut être lié à l’anesthésie, quelles que soient ses modalités, ou à la chirurgie.
La première cause qui vient l’esprit est l’hypothermie. Durant une intervention le patient peut se refroidir facilement. Les principaux facteurs qui viennent à l’esprit sont les apports de fluides, la perte du frisson musculaire, la vasodilatation liée aux médicaments d’anesthésie (avec redistribution du sang périphérique vers le noyau central)
Le magnésium est un cation majoritairement intracellulaire. Il n’y a que 1% du pool magnésien en extracellulaire. On peut globalement retenir que le magnésium a un effet inhibiteur calcique. L’administration de magnésium peut être utile comme adjuvant aux médicaments permettant une anesthésie générale.
La lidocaïne intraveineuse a des vertus analgésiques. Son utilisation comme anesthésique local ou pour une anesthésie loco-régionale est bien connue mais en IV ce médicament reste peu usité en France.
Après l’ECN, en bon polard, j’ai acheté mon premier livre d’anesthésie à l’étranger. Clinical Anesthesiology de Morgan. Evidemment je ne comprenais rien à ce bouquin. Spécialité mystérieuse. Je me souviens avoir été particulièrement surpris de l’utilisation de la lidocaïne en IV pour intuber. Une fois que j’ai commencé les stages d’interne, je n’ai jamais vu personne utilisé de la lidocaïne en IV pour faciliter une intubation. J’ai commencé à me demander si ça relevait de la science-fiction…